题目内容
Ⅰ.某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H2O2的分解反应.
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
①从设计原理看,实验中的待测数据是
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]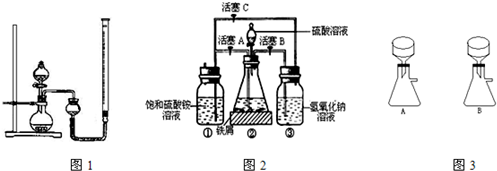
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
+5Fe2++8H+=Mn2++5Fe3++4H2O
试求产品中摩尔盐的质量分数
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,
干燥
干燥
,然后研细;⑤检查④中洗涤是否完全的操作是取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净
取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净
.(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
相同时间内产生气体的体积(或产生相同体积气体所需要的时间)
相同时间内产生气体的体积(或产生相同体积气体所需要的时间)
.②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.
CuO的质量在反应前后是否发生改变
CuO的质量在反应前后是否发生改变
.Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]

在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞
A
A
,打开活塞B、C
B、C
(填字母).向容器①中通入氢气的目的是赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+
赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+
.(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是
A
A
.(填A或B)(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
- 4 |
试求产品中摩尔盐的质量分数
80%
80%
.(NH4)2SO4?FeSO4?6H2O的相对分子质量为392.分析:Ⅰ.(1)④、混合物过滤,洗涤,干燥后才能研细.
⑤、由工艺流程可知④中的CuO可能含有硫酸铜、硫酸钠杂质,用BaCl2溶液检验洗涤后的滤液中是否含有硫酸根.
(2)①由表中信息可知,双氧水、催化剂一定,比较催化能力,相同时间内生成的气体体积越多(或产生相同体积气体所需要的时间越短),催化能力越强.
②催化剂在反应前后,化学性质不变,质量不变.
Ⅱ.(2)由装置图可知,容器②的长导管插入液面以下,氢气只能从容器②的短导管出来,经过容器③加向容器①中.
通入氢气排尽装置内空气,防止Fe2+氧化.
(3)布氏漏斗的颈下口斜口与抽滤瓶的支管相对.
(4)根据关系式5Fe2+~MnO4-计算24.50g产品中Fe2+的物质的量,由(NH4)2SO4?FeSO4?6H2O可知Fe2+的物质的量等于莫尔盐的物质的量,再根据m=nM计算莫尔盐的质量,利用质量分数定义计算.
⑤、由工艺流程可知④中的CuO可能含有硫酸铜、硫酸钠杂质,用BaCl2溶液检验洗涤后的滤液中是否含有硫酸根.
(2)①由表中信息可知,双氧水、催化剂一定,比较催化能力,相同时间内生成的气体体积越多(或产生相同体积气体所需要的时间越短),催化能力越强.
②催化剂在反应前后,化学性质不变,质量不变.
Ⅱ.(2)由装置图可知,容器②的长导管插入液面以下,氢气只能从容器②的短导管出来,经过容器③加向容器①中.
通入氢气排尽装置内空气,防止Fe2+氧化.
(3)布氏漏斗的颈下口斜口与抽滤瓶的支管相对.
(4)根据关系式5Fe2+~MnO4-计算24.50g产品中Fe2+的物质的量,由(NH4)2SO4?FeSO4?6H2O可知Fe2+的物质的量等于莫尔盐的物质的量,再根据m=nM计算莫尔盐的质量,利用质量分数定义计算.
解答:解:Ⅰ.(1)④、混合物过滤,洗涤,干燥后才能研细;
故答案为:干燥.
⑤、由工艺流程可知④中的CuO可能含有硫酸铜、硫酸钠杂质,取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净.
故答案为:取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净.
(2)①由表中信息可知,双氧水、催化剂一定,比较催化能力,相同时间内生成的气体体积越多(或产生相同体积气体所需要的时间越短),催化能力越强.所以应测量的数据为相同时间内产生气体的体积(或产生相同体积气体所需要的时间).
故答案为:相同时间内产生气体的体积(或产生相同体积气体所需要的时间).
②催化剂在反应前后,化学性质不变,质量不变.故还需CuO的质量在反应前后是否发生改变.
故答案为:CuO的质量在反应前后是否发生改变.
Ⅱ.(2)由装置图可知,向容器①中通入氢气,应关闭活塞A,打开活塞B、C.
硫酸铵溶液中的溶解O2,容器①液面上部有O2,Fe2+易被氧化为Fe3+,通入氢气赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+.
故答案为:A;B、C;赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+.
(3)布氏漏斗的颈下口斜口应与抽滤瓶的支管相对,有利于减压抽滤,故A正确,B错误.
故选:A.
(4)令24.50g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.1000mol/L×10
所以x=
=0.05mol.
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的为0.05mol,
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的质量为0.05mol×392g/mol=19.6g.
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的质量分数为
×100%=80%.
故答案为:80%.
故答案为:干燥.
⑤、由工艺流程可知④中的CuO可能含有硫酸铜、硫酸钠杂质,取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净.
故答案为:取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净.
(2)①由表中信息可知,双氧水、催化剂一定,比较催化能力,相同时间内生成的气体体积越多(或产生相同体积气体所需要的时间越短),催化能力越强.所以应测量的数据为相同时间内产生气体的体积(或产生相同体积气体所需要的时间).
故答案为:相同时间内产生气体的体积(或产生相同体积气体所需要的时间).
②催化剂在反应前后,化学性质不变,质量不变.故还需CuO的质量在反应前后是否发生改变.
故答案为:CuO的质量在反应前后是否发生改变.
Ⅱ.(2)由装置图可知,向容器①中通入氢气,应关闭活塞A,打开活塞B、C.
硫酸铵溶液中的溶解O2,容器①液面上部有O2,Fe2+易被氧化为Fe3+,通入氢气赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+.
故答案为:A;B、C;赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+.
(3)布氏漏斗的颈下口斜口应与抽滤瓶的支管相对,有利于减压抽滤,故A正确,B错误.
故选:A.
(4)令24.50g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.1000mol/L×10
所以x=
| 0.01L×0.1000mol/L×10 ×5 |
| 1 |
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的为0.05mol,
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的质量为0.05mol×392g/mol=19.6g.
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的质量分数为
| 19.6g |
| 24.50g |
故答案为:80%.
点评:本题以莫尔盐的制备为载体,考察物质分离提纯等有关实验操作、实验原理与装置的理解分析与评价、对催化能力的探究实验的理解、氧化还原反应滴定应用以计算、以及在新情境下综合运用知识解决问题的能力等.题目有一定的难度.需学生具有扎实的基础知识与灵活运用知识解决问题的能力.注意(4)中计算,容易忽略所取溶液体积,为易错点.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
