摘要:分析学情把握现状.做好针对性措施 我们要结合一轮复习的学生状况.在二轮复习采取针对性的强化训练.最好能做到对学生易错点和热点逐一筛选.没过关的学生.采取针对性的单独强化训练.一次过滤一部分.直到有能力掌握的学生全部过关.
网址:http://m.1010jiajiao.com/timu3_id_83216[举报]
 (2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:(1)已知该产业链中某反应的平衡常数表达式为:K=
| C(H2)?C(CO) |
| C(H2O) |
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
.(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
0.08mol/(L?min)
0.08mol/(L?min)
②比较此时正、逆反应速率的大小:v正
>
>
v逆(填“>”、“<”或“=”)③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向
正向
正向
(填“逆向”、“正向”或“不”)移动,平衡常数K不变
不变
(填“增大”、“减小”或“不变”).(3)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:N2(g)+O2(g)→2NO (g)-180.8kJ,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是
BC
BC
.| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大.
(2012?和平区一模)几种短周期元素的原子半径及主要化合价见下表:
(1)分析上表的有关数据,并结合已学过知识,请按要求回答下列问题.
①写出D元素在周期表中的位置
②常温下这几种元素形成的单质能与水反应的有
③B、C、D最高价氧化物对应的水化物的酸性由大到小的顺序为
④若F与E同周期,则其原子半径的最精确的范围是
(2)由上述部分元素组成的物质间,在一定条件下,可发生下图所示的变化(反应中生成的水没有写出)请回答:

①固体A是(写化学式)
②反应Ⅰ的化学方程式
③反应Ⅱ的化学方程式
查看习题详情和答案>>
| 元素代号 | A | B | C | D | E | F |
| 化合价 | -2 | -1 | -2、+6 | +4、-4 | +1 | +2 |
| 原子半径(nm) | 0.074 | 0.099 | 0.102 | 0.117 | 0.186 |
①写出D元素在周期表中的位置
第三周期第ⅣA族
第三周期第ⅣA族
.②常温下这几种元素形成的单质能与水反应的有
Na、Cl2
Na、Cl2
(填化学式).③B、C、D最高价氧化物对应的水化物的酸性由大到小的顺序为
HClO4>H2SO4>H2SiO3
HClO4>H2SO4>H2SiO3
(填化学式),B、C、E的最高价氧化物对应的水化物形成溶液,浓度均为0.1 mol/L时,pH由大到小的顺序为NaOH>HClO4>H2SO4
NaOH>HClO4>H2SO4
(填化学式).④若F与E同周期,则其原子半径的最精确的范围是
0.117~0.186nm
0.117~0.186nm
.(2)由上述部分元素组成的物质间,在一定条件下,可发生下图所示的变化(反应中生成的水没有写出)请回答:

①固体A是(写化学式)
Na2O2
Na2O2
.②反应Ⅰ的化学方程式
NaOH+SO2(足量)=NaHSO3
NaOH+SO2(足量)=NaHSO3
.③反应Ⅱ的化学方程式
SO2+Br2+2H2O=H2SO4+2HBr
SO2+Br2+2H2O=H2SO4+2HBr
.下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
Fe3O4+4H2
⑤2H2O
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
(2)在这些氧化还原反应中,
水只作氧化剂的反应是
水只作还原剂的反应是
水既作氧化剂,又作还原剂是
水既不作氧化剂,又不作还原剂是
(3)根据你的理解,氧化还原反应的实质是
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
查看习题详情和答案>>
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
| ||
⑤2H2O
| ||
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
③
③
(填编号).(2)在这些氧化还原反应中,
水只作氧化剂的反应是
①④
①④
(填编号);水只作还原剂的反应是
⑥
⑥
(填编号);水既作氧化剂,又作还原剂是
⑤
⑤
(填编号);水既不作氧化剂,又不作还原剂是
②
②
(填编号).(3)根据你的理解,氧化还原反应的实质是
C
C
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
是
是
(填“是”或“不是”),若是,这个反应的氧化剂是3NO2
3NO2
,还原剂是3NO2
3NO2
.由本题所给的①、②两条信息,结合已学知识,回答下列问题.
①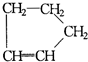 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:


(1)写出异戊二烯臭氧分解的各种产物的结构简式
(2)a mol某烃CnH2n-2(该分子中无-C≡C-)和 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是:
)b mol,则a和b的代数关系是:
(3)写出由环己醇( )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
(4)某烃A的化学式为C10H16,A经臭氧分解可得到等物质的量的两种产物,其结构简式分别为HCHO和 .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
 ,B
,B
 .
.
(5)从香精油中分离到一种化合物[A](C10H16),1mol[A]在催化加氢时可吸收2mol氢气;1mol[A]经臭氧氧化反应再加锌粉水解可得到1mol丙酮[(CH3)2C=O]和1mol3,6-二羰基庚醛 ,则推测得[A]的结构式为
,则推测得[A]的结构式为

 .
.
(6)一定量的化学式均为C4H8的不饱和烃的混合气体,经臭氧分解后生成8.7g酮、0.45mol的醛(其中甲醛有0.21mol).试通过计算回答下列问题:
(a)氧化后生成哪些物质?写出结构简式
(b)混合气体中含哪几种烃(写结构简式)?其物质的量之比为多少?
查看习题详情和答案>>
①
 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:

(1)写出异戊二烯臭氧分解的各种产物的结构简式
HCHO、

HCHO、
,它们的物质的量之比为
2:1
2:1
.(2)a mol某烃CnH2n-2(该分子中无-C≡C-)和
 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是:
)b mol,则a和b的代数关系是:b=4a
b=4a
或b=2a
b=2a
.(3)写出由环己醇(
 )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式① 、
、
② 、
、
③ 、
、
④
 、
、②
 、
、③
 、
、④

① 、
、
② 、
、
③ 、
、
④
. 、
、②
 、
、③
 、
、④

(4)某烃A的化学式为C10H16,A经臭氧分解可得到等物质的量的两种产物,其结构简式分别为HCHO和
 .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A



(5)从香精油中分离到一种化合物[A](C10H16),1mol[A]在催化加氢时可吸收2mol氢气;1mol[A]经臭氧氧化反应再加锌粉水解可得到1mol丙酮[(CH3)2C=O]和1mol3,6-二羰基庚醛
 ,则推测得[A]的结构式为
,则推测得[A]的结构式为 

(6)一定量的化学式均为C4H8的不饱和烃的混合气体,经臭氧分解后生成8.7g酮、0.45mol的醛(其中甲醛有0.21mol).试通过计算回答下列问题:
(a)氧化后生成哪些物质?写出结构简式
CH3CH2CHO、CH3CHO、HCHO、(CH3)2CO
CH3CH2CHO、CH3CHO、HCHO、(CH3)2CO
.(b)混合气体中含哪几种烃(写结构简式)?其物质的量之比为多少?
(CH3)2C=CH2、CH3CH2CH=CH2、CH3CH=CHCH3
(CH3)2C=CH2、CH3CH2CH=CH2、CH3CH=CHCH3
,5:2:3
5:2:3
.物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学知识的回答:
(1)A为0.1mol?L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
(2)B为0.1mol?L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):
实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S)?Ag+(aq)+Cl-(aq)
在25℃时,氯化银的Ksp=1.8×10-10mol2?L-2.现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2mol?L-1AgNO3溶液中;③100mL 0.1mol?L-1氯化铝溶液中;④100mL 0.1mol?L-1盐酸溶液中.充分搅抖后,相同温度下银离子浓度由大到小的顺序是
查看习题详情和答案>>
(1)A为0.1mol?L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
.(2)B为0.1mol?L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):
HCO3+H2O?H2CO3+OH-;HCO3-?H++CO32-
HCO3+H2O?H2CO3+OH-;HCO3-?H++CO32-
;H2O?H++OH-
H2O?H++OH-
;实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:
HCO3-的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性
HCO3-的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性
.(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入
盐酸
盐酸
目的是抑制铁离子的水解
抑制铁离子的水解
;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为3HCO3-+Fe3+=Fe(OH)3↓+3CO2↑
3HCO3-+Fe3+=Fe(OH)3↓+3CO2↑
.(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S)?Ag+(aq)+Cl-(aq)
在25℃时,氯化银的Ksp=1.8×10-10mol2?L-2.现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2mol?L-1AgNO3溶液中;③100mL 0.1mol?L-1氯化铝溶液中;④100mL 0.1mol?L-1盐酸溶液中.充分搅抖后,相同温度下银离子浓度由大到小的顺序是
②①④③
②①④③
(填写序号);②中氯离子的浓度为9×10-10
9×10-10
mol?L-1,③中银离子的浓度为6.0×10-10
6.0×10-10
mol?L-1.