摘要:22.在某温度下.反应⇌/mol在密闭容器中达到平衡.下列说法中正确的是 ( ) A.温度不变.增大体积.ClF3的产率提高 B.降低温度.体积不变.F2的转化率降低 C.升高温度.增大体积.有利于平衡向正反应方向移动 D.温度不变.减小体积.CIF的转化率增大 答案: 22.D 当改变影响化学平衡的一个条件时.平衡向阻止这种改变的方向移动
网址:http://m.1010jiajiao.com/timu3_id_82766[举报]
(1)已知可逆反应:M(g)+N(g)?P(g)+Q(g);△H>0,请回答下列问题.
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
②在某温度下起始反应物的浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
(2)盖斯定律在生产和科学研究中有很重要的意义.试根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
(3)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,c(CO32-):c(SO42-)=
[已知Ksp(Ba SO4)=1.3×10-10,Ksp(BaCO3)=2.6×10-9].
查看习题详情和答案>>
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
CF
CF
(填序号).A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
②在某温度下起始反应物的浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
;若保持温度不变,起始反应物的浓度改为:c(M)=4mol?L-1,c(N)=a mol?L-1,达到平衡后,c(P)=2mol?L-1,则a=6
6
mol?L-1.(2)盖斯定律在生产和科学研究中有很重要的意义.试根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
.(3)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,c(CO32-):c(SO42-)=
20:1
20:1
.[已知Ksp(Ba SO4)=1.3×10-10,Ksp(BaCO3)=2.6×10-9].
 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:(1)关于能量变化的研究已知:
①2CH3OH(1)+3CO2(g)=2CO2(g)+4H2O(g)△H=-akjmol-
②CH3OH(1)+O2(g)=CO(g)+2H2O(1)△-bkjmol -
③H2O(g)=H2O(1)△H=-ckjmol-
则:2CO(g)+O2(g)=2CO2(g)△H=
(2)关于反应速率和限度的研究
①已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
②已知2SO2(g)+O2(g)?2SO3(g):△H=-196kjmol,在一个容积为2L的容器中加入2molSO2和lmol O2,在某温度下充分反应,经过30min达到平衡,放出热量176.94kJ.如果用SO2表示该反应的反应速率,则v(SO2)=
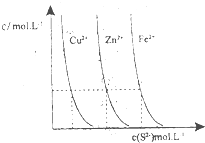
③图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是
(3)关于电化学的研究全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:VO2++2H++V2+
| 放电 |
| 通电 |
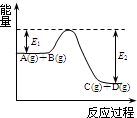 (1)反应A(g)+B(g)
(1)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.①该反应是
放热
放热
反应(填“吸热”“放热”);②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
减小
减小
,E2减小
减小
(填“增大”“减小”“不变”);(2)已知可逆反应:M(g)+N(g)
 P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
BCF
BCF
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.③若反应温度不变,反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,a=
6
6
mol?L-1.已知可逆反应:M(g)+N(g)═2P(g)+Q(g)正反应为吸热反应;请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
(2)其它条件不变,反应温度升高,M的转化率
(3)其它条件不变,在反应的密闭容器中通入氩气(不参加反应).达到平衡后,P的百分含量将
查看习题详情和答案>>
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.(2)其它条件不变,反应温度升高,M的转化率
增大
增大
(填“增大“‘减小”或“不变”).(3)其它条件不变,在反应的密闭容器中通入氩气(不参加反应).达到平衡后,P的百分含量将
不变
不变
(填“增大”“减小”或“不变”).(2008?宁夏)已知可逆反应:M(g)+N(g)?P(g)+Q(g)△H>0,请回答下列问题.
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
(2)若反应温度升高,M的转化率
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,a=
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol?L-1,达到平衡后,M的转化率为
查看习题详情和答案>>
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.(2)若反应温度升高,M的转化率
增大
增大
(填“增大”、“减小”或“不变”)(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,a=
6
6
.(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol?L-1,达到平衡后,M的转化率为
41%
41%
.