摘要:2.本节内容涉及众多氧化还原反应.知识容量较大.学习时要善于归纳.小结.尽量使所学知识条理化.系统化.
网址:http://m.1010jiajiao.com/timu3_id_82377[举报]
(2013?德州二模)2012年冬天,我国城市空气污染状况受到人们的强烈关注.在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标.为了测定空气中的SO2含量,有三位同学分别采用了以下测定方法.
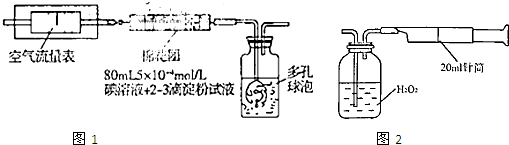
I.氧化还原法:甲同学拟采用图1所示的装置进行实验:
(1)该实验需要80mL5×10-4mol/L的碘溶液,甲同学应称量I2
(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因
Ⅱ.重量法:乙同学拟用图2所示简易装置进行实验.实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL.的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2═H2SO4).在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg.
(3)取样处空气中SO2含量为
(4)已知,常温下BaSO3的KSP为5.48×10-7饱和亚硫酸溶液中c(SO2-3)=6.3×10-8mol/L.
有同学认为以上实验不必用H2O2吸收SO2,直接用0.1mol/L BaCl2溶液来吸收SO2即可产生沉淀,请用以上数据分析这样做是否可行
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的.该电池总的化学反应原理为:2SO2+O2+2H2O═2H2SO4
(5)请写出该电池负极的电极反应式
查看习题详情和答案>>

I.氧化还原法:甲同学拟采用图1所示的装置进行实验:
(1)该实验需要80mL5×10-4mol/L的碘溶液,甲同学应称量I2
0.013g
0.013g
g(精确到0.001),选择100
100
mL的容量瓶进行配制.该实验所涉及的氧化还原反应原理为I2+2H2O+SO2=H2SO4+2HI
I2+2H2O+SO2=H2SO4+2HI
(用化学方程式表示),该实验原理是利用了SO2的还原性
还原性
性.(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因
装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失(其他合理答案即可)
装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失(其他合理答案即可)
.Ⅱ.重量法:乙同学拟用图2所示简易装置进行实验.实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL.的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2═H2SO4).在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg.
(3)取样处空气中SO2含量为
0.025
0.025
mg/L(精确到0.001).(4)已知,常温下BaSO3的KSP为5.48×10-7饱和亚硫酸溶液中c(SO2-3)=6.3×10-8mol/L.
有同学认为以上实验不必用H2O2吸收SO2,直接用0.1mol/L BaCl2溶液来吸收SO2即可产生沉淀,请用以上数据分析这样做是否可行
因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀
因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀
.III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的.该电池总的化学反应原理为:2SO2+O2+2H2O═2H2SO4
(5)请写出该电池负极的电极反应式
SO2+2H2O-2e-═2SO42-+4H+
SO2+2H2O-2e-═2SO42-+4H+
.(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,用化学方程式表示该反应的原理:
(2)炒菜时,经常加入少量的料酒(含乙醇)和醋,可使菜变得香醇可口,用化学方程式表示该反应的原理:
(3)NaHCO3是制作糕点的常用疏松剂,写出NaHCO3受热分解的化学方程式
(4)CH4与Cl2在光照条件下能生成CH3Cl,写出该反应的化学方程式:
(5)向硫酸亚铁溶液中滴入氢氧化钠溶液,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,此过程中涉及的氧化还原反应的化学方程式为:
查看习题详情和答案>>
3HCl+Al(OH)3═AlCl3+3H2O
3HCl+Al(OH)3═AlCl3+3H2O
.(2)炒菜时,经常加入少量的料酒(含乙醇)和醋,可使菜变得香醇可口,用化学方程式表示该反应的原理:
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
| 浓硫酸 |
| △ |
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
.| 浓硫酸 |
| △ |
(3)NaHCO3是制作糕点的常用疏松剂,写出NaHCO3受热分解的化学方程式
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
.
| ||
(4)CH4与Cl2在光照条件下能生成CH3Cl,写出该反应的化学方程式:
CH4+Cl2
CH3Cl+HCl
| 光 |
CH4+Cl2
CH3Cl+HCl
.| 光 |
(5)向硫酸亚铁溶液中滴入氢氧化钠溶液,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,此过程中涉及的氧化还原反应的化学方程式为:
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.(2013?临沂二模)铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中.工业上用铝土矿制备铝的某种化合物的工艺流程如下.
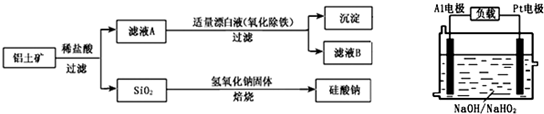
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO-+
②检验滤液B中是否还含有铁元素的方法为:
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
A.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO2-═2AlO2-+OH-+H2O
①正极反应式为
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的原因之一,电极被腐蚀的离子方程式为
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在).不采用氯化铝溶液的原因是
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为
查看习题详情和答案>>

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO-+
5H2O
5H2O
═□Fe(OH)3↓+□C1-+4H+
4H+
.②检验滤液B中是否还含有铁元素的方法为:
取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素
取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素
(注明试剂、现象).③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
c
c
(填代号).A.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
过滤
过滤
(填操作名称)、洗涤.(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO2-═2AlO2-+OH-+H2O
①正极反应式为
HO2-+2e-+H2O=3OH-
HO2-+2e-+H2O=3OH-
.②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的原因之一,电极被腐蚀的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在).不采用氯化铝溶液的原因是
氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气
氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气
.(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为
b
b
(填代号).
探究实验:检验 Fe2+的方法
实验步骤:(1)在两支试管中分别加入10mlFeCl3和10mlFeCl2溶液,然后各滴入几滴KSCN溶液,观察现象.
(2)在盛有FeCl2和KSCN溶液的试管中滴入几滴新配置的氯水,观察现象.
(1)实验现象:步骤1中盛10mlFeCl2溶液的试管中溶液
(2)步骤2中涉及的氧化还原反应的离子方程式为:
(3)欲证明某溶液中不含Fe3+可能含有Fe2+,下列实验操作的最佳顺序为
①加少量氯水 ②加少量KMnO4溶液 ③加少量KSCN
A、①③B、②③C、③①D、①②
查看习题详情和答案>>
实验步骤:(1)在两支试管中分别加入10mlFeCl3和10mlFeCl2溶液,然后各滴入几滴KSCN溶液,观察现象.
(2)在盛有FeCl2和KSCN溶液的试管中滴入几滴新配置的氯水,观察现象.
(1)实验现象:步骤1中盛10mlFeCl2溶液的试管中溶液
无明显现象
无明显现象
步骤2中溶液溶液变为血红色
溶液变为血红色
(2)步骤2中涉及的氧化还原反应的离子方程式为:
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
(3)欲证明某溶液中不含Fe3+可能含有Fe2+,下列实验操作的最佳顺序为
c
c
①加少量氯水 ②加少量KMnO4溶液 ③加少量KSCN
A、①③B、②③C、③①D、①②