题目内容
(2013?德州二模)2012年冬天,我国城市空气污染状况受到人们的强烈关注.在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标.为了测定空气中的SO2含量,有三位同学分别采用了以下测定方法.
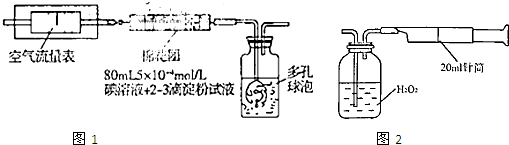
I.氧化还原法:甲同学拟采用图1所示的装置进行实验:
(1)该实验需要80mL5×10-4mol/L的碘溶液,甲同学应称量I2
(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因
Ⅱ.重量法:乙同学拟用图2所示简易装置进行实验.实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL.的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2═H2SO4).在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg.
(3)取样处空气中SO2含量为
(4)已知,常温下BaSO3的KSP为5.48×10-7饱和亚硫酸溶液中c(SO2-3)=6.3×10-8mol/L.
有同学认为以上实验不必用H2O2吸收SO2,直接用0.1mol/L BaCl2溶液来吸收SO2即可产生沉淀,请用以上数据分析这样做是否可行
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的.该电池总的化学反应原理为:2SO2+O2+2H2O═2H2SO4
(5)请写出该电池负极的电极反应式

I.氧化还原法:甲同学拟采用图1所示的装置进行实验:
(1)该实验需要80mL5×10-4mol/L的碘溶液,甲同学应称量I2
0.013g
0.013g
g(精确到0.001),选择100
100
mL的容量瓶进行配制.该实验所涉及的氧化还原反应原理为I2+2H2O+SO2=H2SO4+2HI
I2+2H2O+SO2=H2SO4+2HI
(用化学方程式表示),该实验原理是利用了SO2的还原性
还原性
性.(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因
装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失(其他合理答案即可)
装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失(其他合理答案即可)
.Ⅱ.重量法:乙同学拟用图2所示简易装置进行实验.实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL.的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2═H2SO4).在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg.
(3)取样处空气中SO2含量为
0.025
0.025
mg/L(精确到0.001).(4)已知,常温下BaSO3的KSP为5.48×10-7饱和亚硫酸溶液中c(SO2-3)=6.3×10-8mol/L.
有同学认为以上实验不必用H2O2吸收SO2,直接用0.1mol/L BaCl2溶液来吸收SO2即可产生沉淀,请用以上数据分析这样做是否可行
因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀
因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀
.III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的.该电池总的化学反应原理为:2SO2+O2+2H2O═2H2SO4
(5)请写出该电池负极的电极反应式
SO2+2H2O-2e-═2SO42-+4H+
SO2+2H2O-2e-═2SO42-+4H+
.分析:(1)根据数据算出需要碘的质量;需要100mL容量瓶;碘和二氧化硫的反应方程式;利用化合价变化判断;
(2)从装置的严密性、二氧化硫的溶解性、棉花团的干燥性等方面考虑;
(3)根据S原子质量守恒,生成硫酸钡的物质的量就等于二氧化硫的物质的量,计算出空气中二氧化硫的含量;
(4)根据亚硫酸钡的溶度积,比较溶液中的c(Ba2+)×c(SO32-)乘积与KSP(BaSO3)大小关系,从而判断是否生成沉淀;
(5)负极失去电子,发生氧化反应,根据反应原理写出负极电极反应.
(2)从装置的严密性、二氧化硫的溶解性、棉花团的干燥性等方面考虑;
(3)根据S原子质量守恒,生成硫酸钡的物质的量就等于二氧化硫的物质的量,计算出空气中二氧化硫的含量;
(4)根据亚硫酸钡的溶度积,比较溶液中的c(Ba2+)×c(SO32-)乘积与KSP(BaSO3)大小关系,从而判断是否生成沉淀;
(5)负极失去电子,发生氧化反应,根据反应原理写出负极电极反应.
解答:解:(1)需要配制100mL溶液,溶液中碘的物质的量是:0.1L×5×10-4mol/L=5×10-5mol,碘的质量是:254g/mol×5×10-5mol=0.0127g≈0.013g,配制80mL溶液,没有80mL容量瓶,所以需要配制100mL溶液,选择100mL容量瓶;二氧化硫和碘反应的方程式是:I2+2H2O+SO2=H2SO4+2HI,二氧化硫表现了还原性,
故答案是:0.13g;100; I2+2H2O+SO2=H2SO4+2HI;还原性;
(2)二氧化硫含量减少的原因有:装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失等,
故答案是:装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失等(其他合理答案即可)
(3)白色沉淀是硫酸钡沉淀,物质的量是:
=7.811×10-7mol,取样处空气中SO2含量为:
≈0.025mg/L,
故答案是:0.025;
(4)因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀,
故答案是:c(Ba2+)×c(SO32-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,不会生成沉淀,不可以用氯化钡溶液吸收二氧化硫;
(5)电池总的化学反应原理为:2SO2+O2+2H2O═2H2SO4,负极发生氧化反应,所以负极是二氧化硫失去电子生成硫酸根离子的反应,电极离子反应方程式是:SO2+2H2O-2e-═2SO42-+4H+,
故答案是:SO2+2H2O-2e-═2SO42-+4H+.
故答案是:0.13g;100; I2+2H2O+SO2=H2SO4+2HI;还原性;
(2)二氧化硫含量减少的原因有:装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失等,
故答案是:装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失等(其他合理答案即可)
(3)白色沉淀是硫酸钡沉淀,物质的量是:
| 0.182mg |
| 233g?mol-1 |
| 7.811×10-7mol×64×103mg?mol-1 |
| 0.02L×100 |
故答案是:0.025;
(4)因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀,
故答案是:c(Ba2+)×c(SO32-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,不会生成沉淀,不可以用氯化钡溶液吸收二氧化硫;
(5)电池总的化学反应原理为:2SO2+O2+2H2O═2H2SO4,负极发生氧化反应,所以负极是二氧化硫失去电子生成硫酸根离子的反应,电极离子反应方程式是:SO2+2H2O-2e-═2SO42-+4H+,
故答案是:SO2+2H2O-2e-═2SO42-+4H+.
点评:本题考查了探究空气中二氧化硫含量的方法,涉及了浓度计算、化学方程式的书写等知识,题量比较大,难度稍高.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目