题目内容
(2013?临沂二模)铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中.工业上用铝土矿制备铝的某种化合物的工艺流程如下.
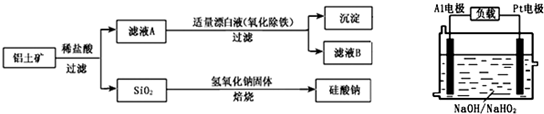
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO-+
②检验滤液B中是否还含有铁元素的方法为:
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
A.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO2-═2AlO2-+OH-+H2O
①正极反应式为
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的原因之一,电极被腐蚀的离子方程式为
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在).不采用氯化铝溶液的原因是
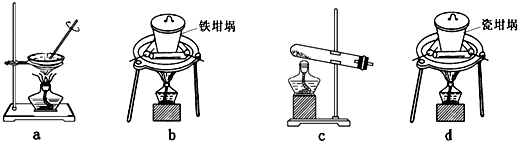
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO-+
5H2O
5H2O
═□Fe(OH)3↓+□C1-+4H+
4H+
.②检验滤液B中是否还含有铁元素的方法为:
取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素
取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素
(注明试剂、现象).③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
c
c
(填代号).A.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
过滤
过滤
(填操作名称)、洗涤.(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO2-═2AlO2-+OH-+H2O
①正极反应式为
HO2-+2e-+H2O=3OH-
HO2-+2e-+H2O=3OH-
.②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的原因之一,电极被腐蚀的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在).不采用氯化铝溶液的原因是
氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气
氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气
.(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为
b
b
(填代号).
分析:(1)①依据流程分析,滤液中含有氯化铁、氯化亚铁、氯化铝,在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性,次氯酸根离子具有氧化性氧化亚铁离子为铁离子在溶液中形成氢氧化铁沉淀除去;依据氧化还原反应电子守恒和原子守恒配平计算写出;
②检验滤液B中是否还含有铁元素的方法为利用铁离子和亚铁离子的检验方法进行检验,先检验是否含铁离子,再检验是否含亚铁离子;
③滤液B中铝元素为氯化铝,依据氢氧化铝溶液强酸强碱,不溶于弱酸弱碱选择;
④加入浓盐酸抑制氯化铝的水解,蒸发浓缩冷却结晶,过滤洗涤;
(2)①依据电池反应分析负极反应和正极反应;
②原电池中铝做负极失电子,在碱溶液中生成偏铝酸盐;
(3)氯化铝溶液中电解氢离子得到电子能力强于铝离子,电解得不到镀铝的结果;
(4)a、蒸发皿中含有二氧化硅和氢氧化钠反应;
b、铁坩埚可以熔融二氧化硅和氢氧化钠;
c、玻璃中含二氧化硅和氢氧化钠反应;
d、瓷坩埚含有二氧化硅和氢氧化钠反应;
②检验滤液B中是否还含有铁元素的方法为利用铁离子和亚铁离子的检验方法进行检验,先检验是否含铁离子,再检验是否含亚铁离子;
③滤液B中铝元素为氯化铝,依据氢氧化铝溶液强酸强碱,不溶于弱酸弱碱选择;
④加入浓盐酸抑制氯化铝的水解,蒸发浓缩冷却结晶,过滤洗涤;
(2)①依据电池反应分析负极反应和正极反应;
②原电池中铝做负极失电子,在碱溶液中生成偏铝酸盐;
(3)氯化铝溶液中电解氢离子得到电子能力强于铝离子,电解得不到镀铝的结果;
(4)a、蒸发皿中含有二氧化硅和氢氧化钠反应;
b、铁坩埚可以熔融二氧化硅和氢氧化钠;
c、玻璃中含二氧化硅和氢氧化钠反应;
d、瓷坩埚含有二氧化硅和氢氧化钠反应;
解答:解:(1)①滤液中含有氯化铁、氯化亚铁、氯化铝,在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性,次氯酸根离子具有氧化性氧化亚铁离子为铁离子在溶液中形成氢氧化铁沉淀除去;亚铁离子被氧化为铁离子在溶液中形成氢氧化铁沉淀,次氯酸根离子被还原为氯离子;反应的两种方程式为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+;
故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+;
②滤液B中是否还含有铁元素的方法为利用铁离子和亚铁离子的检验方法进行检验,取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素;
故答案为:取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素;
③滤液中含有的是氯化铝溶液,将滤液B中的铝元素以沉淀形式析出;
a、氢氧化钠溶液可以沉淀铝离子但过了会溶解氢氧化铝,故a不是最好;
b.硫酸溶液不能沉淀铝离子,故b不符合;
c.过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,故c符合;
d.二氧化碳和氯化铝不反应不能生成氢氧化铝沉淀,故d不符合;
故答案为:c;
④加入浓盐酸抑制氯化铝的水解,蒸发浓缩冷却结晶,过滤,洗涤;
故答案为:过滤;
(2)①H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在,Al-H2O2燃料电池,电池总反应如下:2Al+3HO2-═2AlO2-+OH-+H2O,失电子的再原电池负极发生氧化反应,正极上是得到电子发生还原反应,依据电池反应也是化合价变化判断,正极上的反应物质为HO2-,得到电子生成氢氧根离子,电极反应为:HO2-+2e-+H2O=3OH-;
故答案为:HO2-+2e-+H2O=3OH-;
②原电池中铝在碱溶液中生成偏铝酸盐和氢气;反应的两种方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3),在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在).不采用氯化铝溶液的原因是溶液中氢离子得到电子能力强于铝离子,不能实现度铝的目的.
故答案为:氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气;
(4)a、蒸发皿中含有二氧化硅和氢氧化钠反应;故a不符合;
b、铁坩埚可以熔融二氧化硅和氢氧化钠;故b符合;
c、玻璃中含二氧化硅和氢氧化钠反应;故c不符合;
d、瓷坩埚含有二氧化硅和氢氧化钠反应;故d不符合;
故答案为:b;
故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+;
②滤液B中是否还含有铁元素的方法为利用铁离子和亚铁离子的检验方法进行检验,取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素;
故答案为:取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素;
③滤液中含有的是氯化铝溶液,将滤液B中的铝元素以沉淀形式析出;
a、氢氧化钠溶液可以沉淀铝离子但过了会溶解氢氧化铝,故a不是最好;
b.硫酸溶液不能沉淀铝离子,故b不符合;
c.过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,故c符合;
d.二氧化碳和氯化铝不反应不能生成氢氧化铝沉淀,故d不符合;
故答案为:c;
④加入浓盐酸抑制氯化铝的水解,蒸发浓缩冷却结晶,过滤,洗涤;
故答案为:过滤;
(2)①H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在,Al-H2O2燃料电池,电池总反应如下:2Al+3HO2-═2AlO2-+OH-+H2O,失电子的再原电池负极发生氧化反应,正极上是得到电子发生还原反应,依据电池反应也是化合价变化判断,正极上的反应物质为HO2-,得到电子生成氢氧根离子,电极反应为:HO2-+2e-+H2O=3OH-;
故答案为:HO2-+2e-+H2O=3OH-;
②原电池中铝在碱溶液中生成偏铝酸盐和氢气;反应的两种方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3),在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在).不采用氯化铝溶液的原因是溶液中氢离子得到电子能力强于铝离子,不能实现度铝的目的.
故答案为:氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气;
(4)a、蒸发皿中含有二氧化硅和氢氧化钠反应;故a不符合;
b、铁坩埚可以熔融二氧化硅和氢氧化钠;故b符合;
c、玻璃中含二氧化硅和氢氧化钠反应;故c不符合;
d、瓷坩埚含有二氧化硅和氢氧化钠反应;故d不符合;
故答案为:b;
点评:本题考查了镁铝性质的综合应用和氧化铝提纯制备流程分析应用,原电池、电解池原理的应用和电极反应书写,蒸干灼烧熔融氢氧化钠的仪器选择,题目难度中等.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目