网址:http://m.1010jiajiao.com/timu3_id_81923[举报]
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH | 浓硫酸 | △ |
请根据要求回答下列问题:
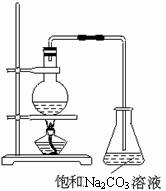
(1)若用右图所示装置来制备少量的乙酸乙酯,其中饱和碳酸钠溶液的作用是
(2)此反应以浓硫酸为催化剂,可能会造成
(3)在图所示的装置中进行50mL 0.50mol/L醋酸与50mL 0.55mol/L NaOH溶液的中和反应.通过测定反应过程中所放出的热量可计算反应热.回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是
②在题述反应条件下,测得反应前醋酸和NaOH溶液的温度均为25.43℃,反应后混合溶液的温度为28.73℃.已知反应前醋酸
和NaOH溶液的密度均为1.0g?cm-3,反应后混合溶液的比热容为c=4.18J/(g?℃).试写出中和反应的热化学方程式:
| 物质 | 室温下色、态 | 密度(g/ml) | 熔点(℃) | 沸点(℃) |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 甲醇 | 无色液体 | 0.7915 | -97.8 | 64.65 |
| 苯甲酸甲酯 | 无色液体 | 1.0888 | -12.3 | 199.6 |
| 乙酸 | 无色液体 | \ | 16.6 | 117.9 |
| 乙醇 | 无色液体 | \ | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | \ | 83.6 | 77.1 |

CH3COOH+C2H5OH
| 浓H2SO4 |
| △ |
图1为课本上制取乙酸乙酯的实验装置图,
①在制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有:增大乙醇的浓度;使用浓硫酸作催化剂和吸水剂,使平衡正向移动;
②在装置B部分,导管不能伸入溶液中的原因是
③反应结束后从所得混合溶液中分离出乙酸乙酯所用的仪器是
(2)实验室用苯甲酸和甲醇反应制取苯甲酸甲酯时用了图2所示装置(画图时省略了铁夹、导管等仪器):
①实验室制备苯甲酸甲酯的化学方程式为:


②此装置中的冷凝管起着冷凝回流的作用,水流应从
生装置,首先会使原料大量蒸馏出去,实验效率大大降低
生装置,首先会使原料大量蒸馏出去,实验效率大大降低
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:请根据要求回答下列问题:
(1)写出该反应的化学方程式
| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
(2)此反应中浓硫酸的作用是
(3)若采用同位素示踪法研究该化学反应,反应物无水乙醇中含有18O,冰醋酸中均为16O,反应后的混合物中,含有18O的物质有
(4)若用如图所示装置来制备少量的乙酸乙酯,锥形瓶中的现象为
CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 、 等。
(2)若用上图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为 、
等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
*选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为 _____。
查看习题详情和答案>>酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。
乙酸乙酯的实验室和工业制法常采用如下反应:
![]()
请根据要求回答下列问题:
⑴欲提高乙酸的转化率,可采取的措施有: 、 等。
⑵若用上图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为:
、 等。
⑶此反应以浓硫酸为催化剂,可能会造成 、 等问题。
⑷目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(/%) | 选择性(/%)* | 反应时间/h | 转化率(/%) | 选择性(/%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为 。
查看习题详情和答案>>