题目内容
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:请根据要求回答下列问题:
(1)写出该反应的化学方程式
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| 加热 |
CH3COOH+C2H5OH
CH3COOC2H5+H2O
.| 浓硫酸 |
| 加热 |
(2)此反应中浓硫酸的作用是
催化剂和吸水剂
催化剂和吸水剂
,饱和碳酸钠的作用是溶解乙醇、吸收乙酸、降低乙酸乙酯的溶解度
溶解乙醇、吸收乙酸、降低乙酸乙酯的溶解度
.(3)若采用同位素示踪法研究该化学反应,反应物无水乙醇中含有18O,冰醋酸中均为16O,反应后的混合物中,含有18O的物质有
C2H5OH、CH3COOC2H5
C2H5OH、CH3COOC2H5
(4)若用如图所示装置来制备少量的乙酸乙酯,锥形瓶中的现象为
出现分层,上层为无色油状液体
出现分层,上层为无色油状液体
,不过往往产率偏低,其原因可能为温度过高发生了副反应;冷凝效果不好,部分原料被蒸出
温度过高发生了副反应;冷凝效果不好,部分原料被蒸出
(任填2种)分析:(1)冰醋酸、无水乙醇和浓硫酸混合加热生成CH3COOC2H5和水;
(2)此反应中浓硫酸的作用催化剂和吸水剂,减少生成物水,使平衡正移;乙酸乙酯在饱和碳酸钠溶液中的溶解度降低,能够溶解乙醇和吸收乙酸;
(3)根据酯化反应原理分析,酸脱羟基醇脱氢;
(4)产物乙酸乙酯难溶于水;原料来不及反应就被蒸出、温度过高发生了副反应都能降低乙酸乙酯的产率;
(2)此反应中浓硫酸的作用催化剂和吸水剂,减少生成物水,使平衡正移;乙酸乙酯在饱和碳酸钠溶液中的溶解度降低,能够溶解乙醇和吸收乙酸;
(3)根据酯化反应原理分析,酸脱羟基醇脱氢;
(4)产物乙酸乙酯难溶于水;原料来不及反应就被蒸出、温度过高发生了副反应都能降低乙酸乙酯的产率;
解答:解:(1)冰醋酸、无水乙醇和浓硫酸混合加热生成CH3COOC2H5和水,反应方程式为:CH3COOH+C2H5OH
CH3COOC2H5+H2O;
故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O;
(2)此反应中浓硫酸的作用催化剂和吸水剂,减少生成物水,使平衡正移;乙酸乙酯在饱和碳酸钠溶液中的溶解度降低,能够溶解乙醇和吸收乙酸;
故答案为:催化剂和吸水剂;溶解乙醇、吸收乙酸、降低乙酸乙酯的溶解度;
(3)根据酯化反应原理分析,酸脱羟基醇脱氢,所以18O只能在C2H5OH、CH3COOC2H5;故答案为:C2H5OH、CH3COOC2H5;
(4)产物乙酸乙酯难溶于水,所以会出现分层,上层为无色油状液体;原料来不及反应就被蒸出、温度过高发生了副反应都能降低乙酸乙酯的产率;
故答案为:出现分层,上层为无色油状液体:温度过高发生了副反应;冷凝效果不好,部分原料被蒸出.
| 浓硫酸 |
| 加热 |
故答案为:CH3COOH+C2H5OH
| 浓硫酸 |
| 加热 |
(2)此反应中浓硫酸的作用催化剂和吸水剂,减少生成物水,使平衡正移;乙酸乙酯在饱和碳酸钠溶液中的溶解度降低,能够溶解乙醇和吸收乙酸;
故答案为:催化剂和吸水剂;溶解乙醇、吸收乙酸、降低乙酸乙酯的溶解度;
(3)根据酯化反应原理分析,酸脱羟基醇脱氢,所以18O只能在C2H5OH、CH3COOC2H5;故答案为:C2H5OH、CH3COOC2H5;
(4)产物乙酸乙酯难溶于水,所以会出现分层,上层为无色油状液体;原料来不及反应就被蒸出、温度过高发生了副反应都能降低乙酸乙酯的产率;
故答案为:出现分层,上层为无色油状液体:温度过高发生了副反应;冷凝效果不好,部分原料被蒸出.
点评:本题考查了乙酸乙酯的制取,注意酯化反应的原理,浓硫酸和饱和碳酸钠溶液的作用,本题注重了教材基础知识,难度不高.

练习册系列答案
相关题目
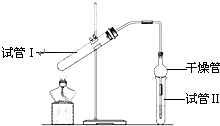 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图的装置制备乙酸乙酯.(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯
微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 |
有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol?L-1 浓硫酸 |
饱和Na2CO3 溶液 |
3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1H2SO4 |
0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH 

