题目内容
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.表格中给出了一些物质的物理常数,请回答下列问题:
(1)乙酸乙酯的实验室制法常采用如下反应:

CH3COOH+C2H5OH
CH3COOC2H5+H2O
图1为课本上制取乙酸乙酯的实验装置图,
①在制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有:增大乙醇的浓度;使用浓硫酸作催化剂和吸水剂,使平衡正向移动;
②在装置B部分,导管不能伸入溶液中的原因是
③反应结束后从所得混合溶液中分离出乙酸乙酯所用的仪器是
(2)实验室用苯甲酸和甲醇反应制取苯甲酸甲酯时用了图2所示装置(画图时省略了铁夹、导管等仪器):
①实验室制备苯甲酸甲酯的化学方程式为:
 .
.
②此装置中的冷凝管起着冷凝回流的作用,水流应从
| 物质 | 室温下色、态 | 密度(g/ml) | 熔点(℃) | 沸点(℃) |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 甲醇 | 无色液体 | 0.7915 | -97.8 | 64.65 |
| 苯甲酸甲酯 | 无色液体 | 1.0888 | -12.3 | 199.6 |
| 乙酸 | 无色液体 | \ | 16.6 | 117.9 |
| 乙醇 | 无色液体 | \ | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | \ | 83.6 | 77.1 |

CH3COOH+C2H5OH
| 浓H2SO4 |
| △ |
图1为课本上制取乙酸乙酯的实验装置图,
①在制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有:增大乙醇的浓度;使用浓硫酸作催化剂和吸水剂,使平衡正向移动;
不断小火加热蒸出产品乙酸乙酯(三者中其沸点最低),使平衡不断正向移动,提高原料利用率
不断小火加热蒸出产品乙酸乙酯(三者中其沸点最低),使平衡不断正向移动,提高原料利用率
等.②在装置B部分,导管不能伸入溶液中的原因是
防止倒吸
防止倒吸
;用饱和Na2CO3溶液而不用NaOH溶液来接收乙酸乙酯的原因是NaOH溶液会使乙酸乙酯水解
NaOH溶液会使乙酸乙酯水解
.③反应结束后从所得混合溶液中分离出乙酸乙酯所用的仪器是
分液漏斗
分液漏斗
,因乙酸乙酯易挥发,所以在振荡操作过程中要注意放气操作
放气操作
.(2)实验室用苯甲酸和甲醇反应制取苯甲酸甲酯时用了图2所示装置(画图时省略了铁夹、导管等仪器):
①实验室制备苯甲酸甲酯的化学方程式为:


②此装置中的冷凝管起着冷凝回流的作用,水流应从
a
a
口进入冷凝效果好(选填“a”或“b”);试简要分析实验室制取苯甲酸甲酯为什么不同样使用制取乙酸乙酯的装置的原因:原料甲醇的沸点低于苯甲酸甲酯的沸点,如果还是使用制备乙酸乙酯的发
生装置,首先会使原料大量蒸馏出去,实验效率大大降低
生装置,首先会使原料大量蒸馏出去,实验效率大大降低
原料甲醇的沸点低于苯甲酸甲酯的沸点,如果还是使用制备乙酸乙酯的发
生装置,首先会使原料大量蒸馏出去,实验效率大大降低
.生装置,首先会使原料大量蒸馏出去,实验效率大大降低
分析:(1)①、酯化反应是可逆的,从化学平衡角度分析,如增大乙醇浓度;蒸出生成的乙酸乙酯等;
②防止A装置中的反应比较剧烈,发生倒吸现象;乙酸乙酯在氢氧化钠溶液中会发生水解;
③采用分液操作将乙酸乙酯分离,用到分液漏斗;乙酸乙酯易挥发,分液漏斗内压强增大,必须放气;
(2)①类比乙酸和乙醇的反应原理;
②根据反应物生成物的物理性质,如沸点进行考虑.
②防止A装置中的反应比较剧烈,发生倒吸现象;乙酸乙酯在氢氧化钠溶液中会发生水解;
③采用分液操作将乙酸乙酯分离,用到分液漏斗;乙酸乙酯易挥发,分液漏斗内压强增大,必须放气;
(2)①类比乙酸和乙醇的反应原理;
②根据反应物生成物的物理性质,如沸点进行考虑.
解答:解:(1)根据酯化反应是可逆过程,故可以不断小火加热蒸出产品乙酸乙酯(三者中其沸点最低),使平衡不断正向移动,提高原料利用率;
故答案为:不断小火加热蒸出产品乙酸乙酯(三者中其沸点最低),使平衡不断正向移动,提高原料利用率;
②制取乙酸乙酯的反应大量放热,容易发生倒吸;氢氧化钠溶液能够和乙酸乙酯发生水解反应;
故答案为:防止倒吸;NaOH溶液会使乙酸乙酯水解;
③通过分液操作分离乙酸乙酯,用到分液漏斗; 乙酸乙酯易挥发,所以在振荡操作过程中分液漏斗内压强增大,容易发生危险,故采取放气操作;
故答案为:分液漏斗;放气操作;
(2)①制备苯甲酸甲酯的反应方程式为: ;
;
故答案为: ;(
;(
②冷凝器采用逆向通水效果好,故从a通水;制取苯甲酸甲酯为什么不同样使用制取乙酸乙酯的装置的原因是:原料甲醇的沸点低于苯甲酸甲酯的沸点,如果还是使用制备乙酸乙酯的发生装置,首先会使原料大量蒸馏出去,实验效率大大降低;
故答案为:a;原料甲醇的沸点低于苯甲酸甲酯的沸点,如果还是使用制备乙酸乙酯的发生装置,首先会使原料大量蒸馏出去,实验效率大大降低.
故答案为:不断小火加热蒸出产品乙酸乙酯(三者中其沸点最低),使平衡不断正向移动,提高原料利用率;
②制取乙酸乙酯的反应大量放热,容易发生倒吸;氢氧化钠溶液能够和乙酸乙酯发生水解反应;
故答案为:防止倒吸;NaOH溶液会使乙酸乙酯水解;
③通过分液操作分离乙酸乙酯,用到分液漏斗; 乙酸乙酯易挥发,所以在振荡操作过程中分液漏斗内压强增大,容易发生危险,故采取放气操作;
故答案为:分液漏斗;放气操作;
(2)①制备苯甲酸甲酯的反应方程式为:
 ;
;故答案为:
 ;(
;(②冷凝器采用逆向通水效果好,故从a通水;制取苯甲酸甲酯为什么不同样使用制取乙酸乙酯的装置的原因是:原料甲醇的沸点低于苯甲酸甲酯的沸点,如果还是使用制备乙酸乙酯的发生装置,首先会使原料大量蒸馏出去,实验效率大大降低;
故答案为:a;原料甲醇的沸点低于苯甲酸甲酯的沸点,如果还是使用制备乙酸乙酯的发生装置,首先会使原料大量蒸馏出去,实验效率大大降低.
点评:本题考查了乙酸乙酯的制取,涉及了苯甲酸甲酯的反应,可以类比乙酸乙酯的制取,本题难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
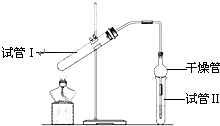 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图的装置制备乙酸乙酯.(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯
微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 |
有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol?L-1 浓硫酸 |
饱和Na2CO3 溶液 |
3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1H2SO4 |
0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH 
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得: