摘要:2.(2010·北京-黄冈预测卷5)工业上以铬铁矿(主要成分为FeO·Cr2O3).碳酸钠.氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O).其主要反应为: ①4FeO·Cr2O3+8Na2CO3+7O28Na2CrO4+2Fe2O3+8CO2 ②2Na2CrO4+H2SO4Na2SO4+Na2Cr2O7+H2O 下列说法中正确的是( ) A.反应①和②均为氧化还原反应 B.反应①的氧化剂是O2.还原剂是FeO·Cr2O3 C.高温下.O2的氧化性大于Fe2O3小于Na2CrO4 D.生成1 mol的Na2Cr2O7时共转移7 mol电子 解析:本题考查氧化还原反应知识.反应①为氧化还原反应.反应②不是,根据氧化剂的氧化性大于氧化产物的氧化性.高温条件下O2的氧化性应大于Fe2O3和Na2CrO4,考虑到反应②是一个可逆反应.反应中生成1 mol的Na2Cr2O7.转移电子的物质的量应大 于7 mol. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_80986[举报]
工业上以铬铁矿、碳酸钠、氧气、和硫酸为原料生产重铬酸钠,其主要反应为:
(1)4FeO?Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应(1)和(2)均为氧化还原反应
B.反应(1)的氧化剂是O2,还原剂是FeO?Cr2O3
C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D.反应(1)中每生成1molNa2CrO4时电子转移3mol
查看习题详情和答案>>
(1)4FeO?Cr2O3+8Na2CO3+7O2
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2(2)2Na2CrO4+H2SO4
 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O下列说法正确的是( )
A.反应(1)和(2)均为氧化还原反应
B.反应(1)的氧化剂是O2,还原剂是FeO?Cr2O3
C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D.反应(1)中每生成1molNa2CrO4时电子转移3mol
查看习题详情和答案>>
工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
①4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2□+8CO2
②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
①4FeO?Cr2O3+8Na2CO3+7O2
| ||
②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
查看习题详情和答案>>
工业上以铬铁矿(主要成分为FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O),其主要反应为
(1)4FeO?Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
(1)4FeO?Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
查看习题详情和答案>>
(2013?浦东新区一模)工业上以铬铁矿(主要成分为FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠晶体(Na2Cr2O7?2H2O),其主要反应为:
(1)4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
(1)4FeO?Cr2O3+8Na2CO3+7O2
| 高温 |
(2)2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
查看习题详情和答案>>
 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:①4FeO?Cr2O3+8Na2CO3+7O2
| ||
. |
②2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O
(1)反应①是在回转窑中进行,反应时需不断搅拌,其目的是
使反应物充分接触,加快反应速率
使反应物充分接触,加快反应速率
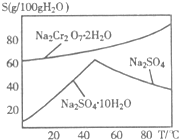
.(2)右图是红矾钠(Na2Cr2O7?2H2O)和Na2SO4的溶解度曲线.从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:先将混合溶液蒸发浓缩,趁热过滤.趁热过滤的目的是
有利于硫酸钠结晶析出,可以防止Na2Cr2O7?2H2O结晶析出
有利于硫酸钠结晶析出,可以防止Na2Cr2O7?2H2O结晶析出
;然后将滤液冷却结晶
冷却结晶
,从而析出红矾钠.(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶解度见右表):
较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7
较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7
.
| 温度 | 0℃ | 100℃ |
| 溶解度 | ||
| 物质 | ||
| K2Cr2O7 | 4.6g | 94.1g |
| KCl | 28g | 55g |
| NaCl | 35g | 39g |
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol?L.重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式
2Fe3++Sn2+=Sn4++2Fe2+
2Fe3++Sn2+=Sn4++2Fe2+
.②如省去步骤③,则所测定的铁的含量
偏高
偏高
(填“偏高”、“偏低”或“无影响”).③步骤5使用的玻璃仪器有
酸式滴定管、锥形瓶
酸式滴定管、锥形瓶
.