摘要:下列各表述与示意图一致的是 A.图①表示25℃时.用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液.溶液的pH随加入酸体积的变化 B.图②中曲线表示反应2SO2(g) + O2(g) 2SO3(g),ΔH < 0 正.逆反应的平衡常数K随温度的变化 C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时.n(Mn2+) 随时间的变化 D.图④中a.b曲线分别表示反应CH2=CH2 (g) + H2(g)CH3CH3(g),ΔH< 0使用和未使用催化剂时.反应过程中的能量变化12.把煤作为燃料可以通过下列两种途径: 途径I: 途径II:先制水煤气: 再燃烧水煤气: 试回答下列问题: (1)判断两种途径放热:途径I放出的热量 (填“大于 .“等于 .“小于 )途径II放出的热量. (2).Q4的数学关系式是 . (3)由于制取水煤气反应里.反应物所具有的总能量 生成物所具有的总能量.那么在化学反应时.反应物应需要 能量才能转化为生成物.因此其反应条件为 . (4)简述煤通过途径II作为燃料的意义. . 答案:(1)等于 (2)Q1=Q2+Q3+Q4 (3)低于,吸收,高温 (4)固体煤经处理变为气体燃料后.不仅在燃烧时可以大大减少和烟尘对大气造成的污染.而且燃烧效率高.也便于输送
网址:http://m.1010jiajiao.com/timu3_id_79424[举报]
室温时,下列各表述与示意图一致的是( )
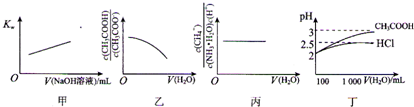

| A、图甲表示在纯水中加入0.01 moL?L-1 NaOH溶液,Kw与NaOH溶液体积变化关系 | ||
B、图乙表示将1 mol?L-1 CH3COONa溶液加水稀释,溶液中
| ||
C、图丙表示0.1mol?L-1 NH3?H2O加水稀释,溶液中
| ||
| D、图丁表示100 mL pH=2的HCl和CH3COOH加水稀释到1000mL时pH变化与水的体积的变化关系 |
下列各表述与示意图一致的是( )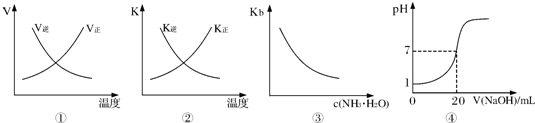

| A、图①表示反应N2(g)+O2(g)?2NO(g)△H>0正、逆反应的速率随温度的变化 | B、图②表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数随温度的变化 | C、图③表示氨水的电离平衡常数随氨水浓度c(NH3?H2O)的变化 | D、图④表示25℃时,用0.1mol?L-1NaOH溶液滴定20mL 0.lmol?L-1盐酸,溶液的pH随加入碱体积的变化 |


