题目内容
室温时,下列各表述与示意图一致的是( )
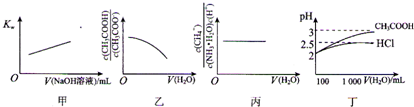

| A、图甲表示在纯水中加入0.01 moL?L-1 NaOH溶液,Kw与NaOH溶液体积变化关系 | ||
B、图乙表示将1 mol?L-1 CH3COONa溶液加水稀释,溶液中
| ||
C、图丙表示0.1mol?L-1 NH3?H2O加水稀释,溶液中
| ||
| D、图丁表示100 mL pH=2的HCl和CH3COOH加水稀释到1000mL时pH变化与水的体积的变化关系 |
分析:A、温度一定Kw不变,不随溶液酸碱性,浓度的变化;
B、依据加水稀释促进水解平衡正向进行分析判断离子浓度比变化;
C、一水合氨的电离平衡常数在一定温度下不变;
D、pH相同的强酸和弱酸稀释相同倍数,强酸溶液pH增大的多.
B、依据加水稀释促进水解平衡正向进行分析判断离子浓度比变化;
C、一水合氨的电离平衡常数在一定温度下不变;
D、pH相同的强酸和弱酸稀释相同倍数,强酸溶液pH增大的多.
解答:解:A、温度一定Kw不变,不随溶液酸碱性,浓度的变化,纯水中加入0.01 moL?L-1 NaOH溶液,Kw不随NaOH溶液体积变化,故A错误;
B、依据加水稀释促进水解平衡正向进行,CH3COO-+H2O?CH3COOH+OH-,溶液中
随加入水的体积增多增大,图象中是减小,故B错误;
C、一水合氨的电离平衡常数在一定温度下不变,0.1mol?L-1 NH3?H2O加水稀释,溶液中
与为平衡常数表达式,加入水的体积变化,比值不变,故C正确;
D、pH相同的强酸和弱酸稀释相同倍数,强酸溶液pH增大的多,100 mL pH=2的HCl和CH3COOH加水稀释到1000mL时pH变化盐酸溶液pH变化大,而图象中是弱酸溶液pH变化大,故D错误;
故选C.
B、依据加水稀释促进水解平衡正向进行,CH3COO-+H2O?CH3COOH+OH-,溶液中
| c(CH3COOH) |
| c(CH3COO-) |
C、一水合氨的电离平衡常数在一定温度下不变,0.1mol?L-1 NH3?H2O加水稀释,溶液中
| c(NH4+) |
| c(NH3?H2O)c(H+) |
D、pH相同的强酸和弱酸稀释相同倍数,强酸溶液pH增大的多,100 mL pH=2的HCl和CH3COOH加水稀释到1000mL时pH变化盐酸溶液pH变化大,而图象中是弱酸溶液pH变化大,故D错误;
故选C.
点评:本题考查了盐类水解的分析应用,溶液中离子积常数和弱电解质电离平衡常数的影响因素分析判断,注意弱电解质溶液中存在的电离平衡,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目

 N2O4(g)达到平衡时NO2的体积分数
N2O4(g)达到平衡时NO2的体积分数 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅
(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 将增大
将增大