摘要:20.如下图所示是电子工业中某原料的生产流程.其中反应②③是你在课本习题中见过.其目的是为了提纯B,物质A-H均为短周期元素组成,G为五原子非极性分子,A-D均是单质且元素原子的最外层电子数目的关系为C>A=B>D,H极易溶于水.且其水溶液为-种强酸. 请回答下列问题: (1)B的电子排布式: ,固体E的晶体类型 ,H中的键型为 , (2)反应①的化学方程式: . (3)与反应①类型相同.且两种单质分属同一主族和不同主族的反应.用化学方程式各写- 例: ①单质属同-主族: ; ②单质属不同主族: o (4)F在工业上有多种用途.写出其中一种用途的化学方程式:
网址:http://m.1010jiajiao.com/timu3_id_77067[举报]
如图所示是电子工业中某原料的生产流程,其中反应②③是你在课本习题中见过,其目的是为了提纯B;物质A-H均为短周期元素组成;G为五原子非极性分子;A-D均是单质且元素原子的最外层电子数目的关系为C>A=B>D;H极易溶于水,且其水溶液为-种强酸.

请回答下列问题:
(1)B的电子排布式:
(2)反应①的化学方程式:
(3)与反应①类型相同,且两种单质分属同一主族和不同主族的反应,用化学方程式各写-例:
①单质属同-主族:
(4)F在工业上有多种用途,写出其中一种用途的化学方程式:
查看习题详情和答案>>

请回答下列问题:
(1)B的电子排布式:
1s22s22p63s23p2
1s22s22p63s23p2
;固体E的晶体类型原子晶体
原子晶体
;H中的键型为δ
δ
(填“π”或“δ”);(2)反应①的化学方程式:
SiO2+2C
Si+2CO↑
| ||
SiO2+2C
Si+2CO↑
.
| ||
(3)与反应①类型相同,且两种单质分属同一主族和不同主族的反应,用化学方程式各写-例:
①单质属同-主族:
2H2S+O2=2S↓+2H2O
2H2S+O2=2S↓+2H2O
;②单质属不同主族:2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(4)F在工业上有多种用途,写出其中一种用途的化学方程式:
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
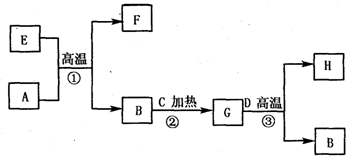 如图所示是电子工业中某原料的生产流程.其中反应②③你可能不熟悉,其目的是为了提纯B;物质A~H均由短周期元素构成;G是五原子分子;A~D均是单质且元素原子的最外层电子数目的关系为C>A=B>D;H极易溶于水,且其水溶液是一种强酸.
如图所示是电子工业中某原料的生产流程.其中反应②③你可能不熟悉,其目的是为了提纯B;物质A~H均由短周期元素构成;G是五原子分子;A~D均是单质且元素原子的最外层电子数目的关系为C>A=B>D;H极易溶于水,且其水溶液是一种强酸.请回答下列问题:
(1)H的电子式
(2)③所属的反应类型是
(3)反应①的化学方程式为
(4)F在工业上有多种用途,写出其中一种用途的化学方程式
如图所示是电子工业中某原料的生产流程。其中反应②③你可能不熟悉,其目的是为了提纯B;物质A~H均由短周期元素构成;G是五原子分子;A~D均是单质且元素原子的最外层电子数目的关系为C>A=B>D;H极易溶于水,且其水溶液是一种强酸。
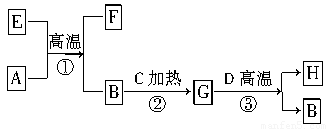
请回答下列问题:
(1)H的电子式________;G的化学式为________。
(2)③所属的反应类型是________。
(3)反应①的化学方程式为_______________________________________。
(4)F在工业上有多种用途,写出其中一种用途的化学方程式:_____________________。
查看习题详情和答案>>
工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.下图(左图)为电解槽的示意图.
(1)这种阳离子交换膜,只允许溶液中的
①H2②Cl2③H+④Cl-⑤Na+⑥OH-
(2)写出在电解过程中阳极发生的电极方程式:
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通.则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇.回答下列问题:
①写出在电解过程中阴极发生的电极方程式
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:
查看习题详情和答案>>
(1)这种阳离子交换膜,只允许溶液中的
③⑤
③⑤
通过.(填下列微粒的编号)①H2②Cl2③H+④Cl-⑤Na+⑥OH-
(2)写出在电解过程中阳极发生的电极方程式:
2Cl─-2e-=Cl2↑
2Cl─-2e-=Cl2↑
.(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通.则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
35.7%
35.7%
.(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇.回答下列问题:

①写出在电解过程中阴极发生的电极方程式
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
.②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:
蒸发结晶
蒸发结晶
.硫酸盐在生产生活中有广泛应用.
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如图1所示:

某研究小组查阅资料得:
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠.该反应的离子方程式是
H2S+OH-
(2)反应C(s)+CO2(g)═2CO(g)的△H=
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温.
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图2所示.
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+使SO42-沉淀
完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图3所示,电池总反应可表示为2H2+O2═2H2O.
请回答:
(5)H+由
(6)b极上发生的电极反应是
查看习题详情和答案>>
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如图1所示:

某研究小组查阅资料得:
BaSO4(s)+4C(s)
| ||
BaSO4(s)+2C(s)
| ||
(1)用过量NaOH溶液吸收气体,得到硫化钠.该反应的离子方程式是
H2S+2OH-═2S2-+H2O
H2S+2OH-═2S2-+H2O
.S2-+H2O?HS-+OH-;HS-+H2O| 高温 |
(2)反应C(s)+CO2(g)═2CO(g)的△H=
+172.5 kJ?mol-1
+172.5 kJ?mol-1
.(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,
使BaSO4得到充分的还原,提高BaS的产量
使BaSO4得到充分的还原,提高BaS的产量
;②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温.
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图2所示.
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+使SO42-沉淀
完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是
④
④
(填序号).Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图3所示,电池总反应可表示为2H2+O2═2H2O.
请回答:
(5)H+由
a
a
极通过固体酸电解质传递到另一极(填a或者b).(6)b极上发生的电极反应是
O2+4e-+4H+═2H2O
O2+4e-+4H+═2H2O
.