题目内容
硫酸盐在生产生活中有广泛应用.
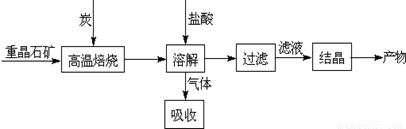
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如图1所示:

某研究小组查阅资料得:
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠.该反应的离子方程式是
H2S+OH-
(2)反应C(s)+CO2(g)═2CO(g)的△H=
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温.
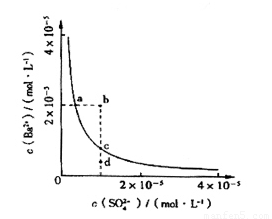
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图2所示.
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+使SO42-沉淀
完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是
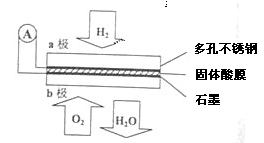
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图3所示,电池总反应可表示为2H2+O2═2H2O.
请回答:
(5)H+由
(6)b极上发生的电极反应是
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如图1所示:

某研究小组查阅资料得:
BaSO4(s)+4C(s)
| ||
BaSO4(s)+2C(s)
| ||
(1)用过量NaOH溶液吸收气体,得到硫化钠.该反应的离子方程式是
H2S+2OH-═2S2-+H2O
H2S+2OH-═2S2-+H2O
.S2-+H2O?HS-+OH-;HS-+H2O| 高温 |
(2)反应C(s)+CO2(g)═2CO(g)的△H=
+172.5 kJ?mol-1
+172.5 kJ?mol-1
.(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,
使BaSO4得到充分的还原,提高BaS的产量
使BaSO4得到充分的还原,提高BaS的产量
;②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温.
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图2所示.
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+使SO42-沉淀
完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是
④
④
(填序号).Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图3所示,电池总反应可表示为2H2+O2═2H2O.
请回答:
(5)H+由
a
a
极通过固体酸电解质传递到另一极(填a或者b).(6)b极上发生的电极反应是
O2+4e-+4H+═2H2O
O2+4e-+4H+═2H2O
.分析:I.(1)硫化氢和氢氧化钠溶液反应生成硫化钠和水;
(2)根据盖斯定律书写;
(3)加入过量C可提高冰晶石的转化率,同时维持反应进行;
(4)①难溶电解质溶液中存在电离平衡;
②加人Na2SO4后平衡逆向移动,但仍在线上移动;
③蒸发使离子浓度增大,d点不可能到c点;
④d点表示Qc<Ksp,溶液不饱和;
II.(5)负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水;
(6)根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O.
(2)根据盖斯定律书写;
(3)加入过量C可提高冰晶石的转化率,同时维持反应进行;
(4)①难溶电解质溶液中存在电离平衡;
②加人Na2SO4后平衡逆向移动,但仍在线上移动;
③蒸发使离子浓度增大,d点不可能到c点;
④d点表示Qc<Ksp,溶液不饱和;
II.(5)负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水;
(6)根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O.
解答:解:Ⅰ.(1)硫化氢和氢氧化钠溶液反应生成硫化钠和水,离子反应方程式为:H2S+2OH-═2S2-+H2O,
故答案为:H2S+2OH-═2S2-+H2O;
(2)BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=571.2kJ?mol-1 ①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=226.2kJ?mol-1 ②
将以上两个热化学方程式相减,然后除以2可得:
C(s)+CO2(g)
2CO(g)△H=
=+172.5kJ?mol-1,
故答案为:+172.5 kJ?mol-1 ;
(3)加入过量C使BaSO4得到充分的还原(或提高BaS的产量),可提高冰晶石的转化率,
故答案为:使BaSO4得到充分的还原(或提高BaS的产量);
(4)①当向含有SO42-的溶液中加入Ba2+使SO42-沉淀完全,此时溶液中还有部分硫酸钡,硫酸钡是强电解质,完全电离,所以溶液中硫酸根离子浓度不是0,故错误;
②硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,故错误;
③d点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,故错误;
④d点表示Qc<Ksp,溶液不饱和,不会有沉淀析出,故正确;
故选④;
Ⅱ.(5)该原电池中,氢气电极为负极,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水是,所以氢离子由负极a移向正极,故答案为:a;
(6)正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4e-+4H+═2H2O,
故答案为:O2+4e-+4H+═2H2O.
故答案为:H2S+2OH-═2S2-+H2O;
(2)BaSO4(s)+4C(s)
| ||
BaSO4(s)+2C(s)
| ||
将以上两个热化学方程式相减,然后除以2可得:
C(s)+CO2(g)
| ||
| 571.2kJ/mol-226.2kJ/mol |
| 2 |
故答案为:+172.5 kJ?mol-1 ;
(3)加入过量C使BaSO4得到充分的还原(或提高BaS的产量),可提高冰晶石的转化率,
故答案为:使BaSO4得到充分的还原(或提高BaS的产量);
(4)①当向含有SO42-的溶液中加入Ba2+使SO42-沉淀完全,此时溶液中还有部分硫酸钡,硫酸钡是强电解质,完全电离,所以溶液中硫酸根离子浓度不是0,故错误;
②硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,故错误;
③d点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,故错误;
④d点表示Qc<Ksp,溶液不饱和,不会有沉淀析出,故正确;
故选④;
Ⅱ.(5)该原电池中,氢气电极为负极,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水是,所以氢离子由负极a移向正极,故答案为:a;
(6)正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4e-+4H+═2H2O,
故答案为:O2+4e-+4H+═2H2O.
点评:本题考查了原电池原理、难溶物的溶解平衡、盖斯定律等知识点,注意原电池中离子的移动方向、难溶电解质在水中的沉淀溶解平衡特点,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 4CO(g)+BaS(s)△H1=+571.2kJ•mol-1
①
4CO(g)+BaS(s)△H1=+571.2kJ•mol-1
①