摘要: (化学鲁科必修1 P59.3题)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔.制造印刷电路板. (1)检验溶液中Fe3+存在的试剂是 .证明Fe3+存在的现象是 . (2)写出FeCl3溶液与金属铜发生反应的化学方程式: . (3)某工程师为了从使用过的腐蚀废液中回收铜.并重新获得FeCl3溶液.准备采用下列步骤: A. 请写出上述实验中加入或生成的有关物质的化学式: ① .② .③ .④ . ⑤ .⑥ . B. 请写出相关反应的化学方程式: .
网址:http://m.1010jiajiao.com/timu3_id_76706[举报]
学习化学应该明确“从生活中来,到生活中去”道理.在生产生活中,我们会遇到各种各样的化学反应.请你写出下列反应的化学方程式.(注意反应条件并配平)
(1)已知氯化铁溶液跟铜反应生成氯化铜和氯化亚铁.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电板
(2)玻璃中含有SiO2,不能用带磨口玻璃塞的试剂瓶保存碱性溶液的原因
(3)胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多
(4)在高温下一氧化碳与氧化铁反应可以制得金属铁
(5)将铁加入硫酸铜溶液中炼铜(湿法炼铜)
(6)工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉(主要成分是氯化钙和次氯酸钙)
查看习题详情和答案>>
(1)已知氯化铁溶液跟铜反应生成氯化铜和氯化亚铁.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电板
2FeCl3+Cu=CuCl2+2FeCl2
2FeCl3+Cu=CuCl2+2FeCl2
.(2)玻璃中含有SiO2,不能用带磨口玻璃塞的试剂瓶保存碱性溶液的原因
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
.(3)胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3HCl=AlCl3+3H2O
.(4)在高温下一氧化碳与氧化铁反应可以制得金属铁
3CO+Fe2O3
3CO2+2Fe
| ||
3CO+Fe2O3
3CO2+2Fe
.
| ||
(5)将铁加入硫酸铜溶液中炼铜(湿法炼铜)
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
.(6)工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉(主要成分是氯化钙和次氯酸钙)
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
(1)检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 .
(2)写出FeCl3溶液与金属铜发生反应的离子方程式
(3)某工程师为了从使用过的腐蚀溶液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
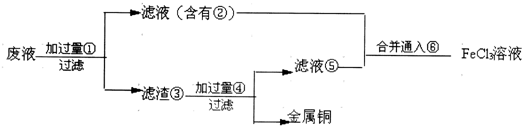
请写出上述实验中加入或生成的有关物质的化学式
① ② ③ ④ ⑤ ⑥ .
查看习题详情和答案>>
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式
(3)某工程师为了从使用过的腐蚀溶液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式
①
(I)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2.
(1)写出该反应的化学方程式
(2)检验溶液中Fe3+存在的试剂是
(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费.通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3 溶液,作为腐蚀液原料循环使用.

(1)步骤①中发生反应的离子方程式
(2)步骤②需加入的试剂A是
(3)步骤③通入的气体B是
(4)为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数.(写出计算过程)
查看习题详情和答案>>
(1)写出该反应的化学方程式
2FeCl3+Cu═2FeCl2+CuCl2
2FeCl3+Cu═2FeCl2+CuCl2
.(2)检验溶液中Fe3+存在的试剂是
KSCN溶液
KSCN溶液
,证明Fe3+存在的现象是溶液变成红色
溶液变成红色
.(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费.通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3 溶液,作为腐蚀液原料循环使用.

(1)步骤①中发生反应的离子方程式
2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu
2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu
.(2)步骤②需加入的试剂A是
HCl
HCl
(填化学式).(3)步骤③通入的气体B是
C12
C12
(填化学式),写出该反应的化学方程式2FeCl2+C12=2FeCl3
2FeCl2+C12=2FeCl3
.(4)为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数.(写出计算过程)
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
(2)某工程师为了从使用过的腐蚀废液(不含FeCl3)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述试验过程中②⑤的化学式:②
请写出①⑥两步反应的离子方程式:
查看习题详情和答案>>
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
2FeCl3+Cu═2FeCl2+CuCl2
2FeCl3+Cu═2FeCl2+CuCl2
;若反应过程中有2mol电子发生转移,会有64
64
g Cu溶解.(2)某工程师为了从使用过的腐蚀废液(不含FeCl3)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述试验过程中②⑤的化学式:②
FeCl2
FeCl2
,⑤FeCl2
FeCl2
.请写出①⑥两步反应的离子方程式:
Fe+Cu2+═Cu+Fe2+
Fe+Cu2+═Cu+Fe2+
;2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中③的化学式:
(4)配制硫酸亚铁溶液时,常在其中加入
(5)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为
①加入足量氯水 ②加入足量NaOH溶液 ③加入少量KSCN溶液
A.①③B.③②C.③①D.①②③
(6)写出向②⑤的混合液中通入⑥的离子方程式
查看习题详情和答案>>
(1)检验溶液中Fe3+存在的试剂是
KSCN
KSCN
(填写化学式),证明Fe3+存在的现象是溶液变红
溶液变红
.(2)写出FeCl3溶液与金属铜发生反应的离子方程式:
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中③的化学式:
Fe、Cu
Fe、Cu
.(4)配制硫酸亚铁溶液时,常在其中加入
铁屑和稀硫酸
铁屑和稀硫酸
.(5)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为
C
C
.①加入足量氯水 ②加入足量NaOH溶液 ③加入少量KSCN溶液
A.①③B.③②C.③①D.①②③
(6)写出向②⑤的混合液中通入⑥的离子方程式
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.