题目内容
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式
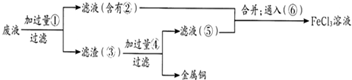
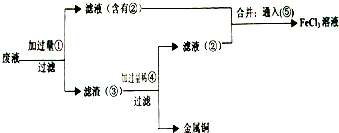
(3)某工程师为了从使用过的腐蚀溶液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
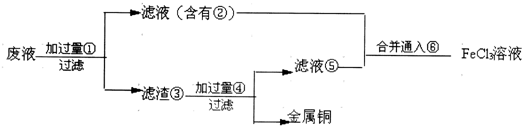
请写出上述实验中加入或生成的有关物质的化学式
①
分析:(1)检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;
(2)铜与氯化铁反应生成氯化铜、氯化亚铁;
(3)反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣③中含有金属铜,故应是废液与过量的Fe反应,滤液②中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,制备氯化铁,据此进行解答.
(2)铜与氯化铁反应生成氯化铜、氯化亚铁;
(3)反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣③中含有金属铜,故应是废液与过量的Fe反应,滤液②中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,制备氯化铁,据此进行解答.
解答:解:(1)检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,
故答案为:KSCN溶液;溶液变为红色;
(2)铜与氯化铁反应生成氯化铜、氯化亚铁,反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(3)由工艺流程可知,滤渣③中含有金属铜,目的是制取氯化铁,废液应该与铁过量的Fe反应,故①Fe;滤液②中含有FeCl2,通入⑥氯气可以得到氯化铁;滤渣③中含有金属Cu、未反应的Fe,加入④盐酸,过滤,回收铜,滤液⑤中含有FeCl2,与滤液②合并,制备氯化铁,
由上述分析可知:①Fe ②FeCl2③Fe和Cu ④HCl ⑤FeCl2⑥Cl2,
故答案为:Fe;FeCl2;Fe和Cu;HCl;FeCl2;Cl2.
故答案为:KSCN溶液;溶液变为红色;
(2)铜与氯化铁反应生成氯化铜、氯化亚铁,反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(3)由工艺流程可知,滤渣③中含有金属铜,目的是制取氯化铁,废液应该与铁过量的Fe反应,故①Fe;滤液②中含有FeCl2,通入⑥氯气可以得到氯化铁;滤渣③中含有金属Cu、未反应的Fe,加入④盐酸,过滤,回收铜,滤液⑤中含有FeCl2,与滤液②合并,制备氯化铁,
由上述分析可知:①Fe ②FeCl2③Fe和Cu ④HCl ⑤FeCl2⑥Cl2,
故答案为:Fe;FeCl2;Fe和Cu;HCl;FeCl2;Cl2.
点评:本题考查了化学工艺流程、常用化学用语、元素化合物性质等知识,题目难度不大,掌握元素化合物的性质是关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目