题目内容
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
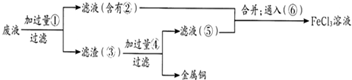
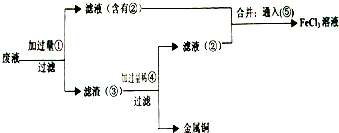
(2)某工程师为了从使用过的腐蚀废液(不含FeCl3)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述试验过程中②⑤的化学式:②
请写出①⑥两步反应的离子方程式:
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
2FeCl3+Cu═2FeCl2+CuCl2
2FeCl3+Cu═2FeCl2+CuCl2
;若反应过程中有2mol电子发生转移,会有64
64
g Cu溶解.(2)某工程师为了从使用过的腐蚀废液(不含FeCl3)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述试验过程中②⑤的化学式:②
FeCl2
FeCl2
,⑤FeCl2
FeCl2
.请写出①⑥两步反应的离子方程式:
Fe+Cu2+═Cu+Fe2+
Fe+Cu2+═Cu+Fe2+
;2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
.分析:(1)氯化铁与铜反应生成氯化亚铁与氯化铁;
反应中铜表现+2价,根据电子转移计算参加反应铜的物质的量,再根据m=cM计算铜的质量;
(2)反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣③中含有金属铜,故应是废液与过量的Fe反应,滤液②中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,制备氯化铁,据此解答.
反应中铜表现+2价,根据电子转移计算参加反应铜的物质的量,再根据m=cM计算铜的质量;
(2)反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣③中含有金属铜,故应是废液与过量的Fe反应,滤液②中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,制备氯化铁,据此解答.
解答:解:(1)氯化铁与铜反应生成氯化亚铁与氯化铁,反应方程式为:2FeCl3+Cu═2FeCl2+CuCl2;
反应中铜表现+2价,2mol电子发生转移,根据电子转移可知参加反应铜的物质的量=
=1mol,故参加反应的铜的质量=1mol×64g/mol=64g,
故答案为:2FeCl3+Cu═2FeCl2+CuCl2;64;
(2)反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣③中含有金属铜,故应是废液与过量的Fe反应,滤液②中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,制备氯化铁,
由上述分析可知,②为FeCl2,⑤为FeCl2;
反应①为Fe+Cu2+═Cu+Fe2+,反应⑥为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:FeCl2;FeCl2;Fe+Cu2+═Cu+Fe2+;2Fe2++Cl2═2Fe3++2Cl-.
反应中铜表现+2价,2mol电子发生转移,根据电子转移可知参加反应铜的物质的量=
| 2mol |
| 2 |
故答案为:2FeCl3+Cu═2FeCl2+CuCl2;64;
(2)反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣③中含有金属铜,故应是废液与过量的Fe反应,滤液②中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,制备氯化铁,
由上述分析可知,②为FeCl2,⑤为FeCl2;
反应①为Fe+Cu2+═Cu+Fe2+,反应⑥为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:FeCl2;FeCl2;Fe+Cu2+═Cu+Fe2+;2Fe2++Cl2═2Fe3++2Cl-.
点评:本题考查化学工艺流程、常用化学用语、元素化合物性质等,难度不大,掌握元素化合物的性质是关键.

练习册系列答案
相关题目