题目内容
(1)写出该反应的化学方程式
(2)检验溶液中Fe3+存在的试剂是
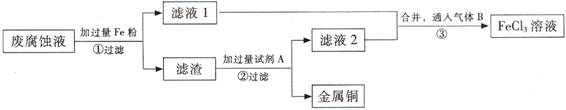
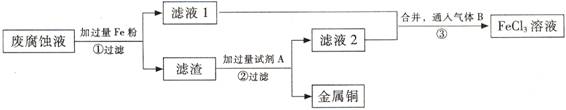
(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费.通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3 溶液,作为腐蚀液原料循环使用.

(1)步骤①中发生反应的离子方程式
(2)步骤②需加入的试剂A是
(3)步骤③通入的气体B是
(4)为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数.(写出计算过程)
(2)检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;
(Ⅱ)(1)印刷电路的废腐蚀液中的CuCl2、FeCl3与铁粉反应生成Fe2+、Cu;
(2)滤渣中含有Fe和Cu,除去其中的Fe选用盐酸;
(3)废腐蚀液加铁粉后,溶液为亚铁离子的溶液,通入氯气得到三氯化铁溶液;
(4)根据生成的氢气求出Fe的量,再求出铜的量,再求质量分数.
故答案为:2FeCl3+Cu═2FeCl2+CuCl2;
(2)检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,发生反应Fe3++3SCN-?Fe(SCN)3,溶液变红,说明Fe3+存在,
故答案为:KSCN溶液;溶液变红色;
(Ⅱ)印刷电路的废腐蚀液中的CuCl2、FeCl3与铁粉反应生成Fe2+、Cu;CuCl2与铁粉反应的离子方程式为:Fe+Cu2+=Fe2++Cu;FeCl3与铁粉反应的离子方程式为:2Fe3+++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu;
(2)滤渣中含有Fe和Cu,若要除去其中的Fe选用盐酸,然后过滤,故答案为:HCl;
(3)废腐蚀液加铁粉后,溶液为亚铁离子的溶液,通入氯气得到三氯化铁溶液,其反应的化学方程式为:2FeCl2+C12=2FeCl3,故答案为:C12;2FeCl2+C12=2FeCl3;
(4)取50g的滤渣与足量的HCl反应,得到5.6L氢气,则n(H2)=
| 5.6L |
| 22.4mol/L |
| 36g |
| 50g |
答:滤渣中铜的质量分数为72%.

I.类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是 Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生称FeCl3,当铁粉过量时产物是FeCl2,为了验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是
⑵设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
实验方法 | 实验现象 | 结论 |
在溶液中加KSCN溶液 |
| 固体物质中有FeCl3 |
在KMnO4溶液中加少量A 溶液 | KmnO4溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:

⑶①写出一个能证明还原性Fe比Cu强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:


四位同学的设计的原电池装置图,符合上述反应原理的是 。
③请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式  O2(g)
O2(g) FeO(s)
△H=-272 kJ·mol-1
FeO(s)
△H=-272 kJ·mol-1  Fe(s)+CO2(g) △H=
。
Fe(s)+CO2(g) △H=
。
 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式