摘要: (2009年高考广东卷·理基)下表是元素周期表的一部分.有关说法正确的是 族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 c d 3 a b e f A. e的氢化物比d的氢化物稳定 B. a.b.e三种元素的原子半径:e>b>a C. 六种元素中.c元素单质的化学性质最活泼 D. c.e.f的最高价氧化物对应的水化物的酸性依次增强
网址:http://m.1010jiajiao.com/timu3_id_76533[举报]
下表为元素周期表的一部,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)请写出②的元素符号
(2)请写出③的最高价氧化物的电子式
 .
.
(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示)
(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
(6)⑦⑧两元素相比较,金属性较强的是
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
查看习题详情和答案>>
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
Be
Be
(2)请写出③的最高价氧化物的电子式


(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
Na>Al>F
Na>Al>F
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示)
HNO3>H2CO3>H2SiO3(或H4SiO4)
HNO3>H2CO3>H2SiO3(或H4SiO4)
.(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
NaOH+HClO4═NaClO4+H2O
NaOH+HClO4═NaClO4+H2O
(6)⑦⑧两元素相比较,金属性较强的是
镁
镁
(填名称),可以验证该结论的实验是(b)(c)
(b)(c)
(填编号).(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
下表为元素周期表的一部,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)请写出②的元素符号
(2)请写出③的最高价氧化物的电子式 .
(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示) .
(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
(6)⑦⑧两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 (填编号).
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性. 查看习题详情和答案>>
| 族周期 | IA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)请写出③的最高价氧化物的电子式 .
(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示) .
(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
(6)⑦⑧两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 (填编号).
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性. 查看习题详情和答案>>
(2011?兖州市三模)下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
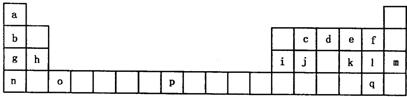
试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)d的氢化物中心原子的杂化方式是
(3)o元素所在族的符号是
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是
(5)f、l、q的氢化物中沸点最高的是
(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点
查看习题详情和答案>>

试回答下列问题:
(1)请写出元素o的基态原子电子排布式
1s22s22p63s23p63d14s2
1s22s22p63s23p63d14s2
,g元素的价电子的四个量子数依次是3,0,0,+
(或-
)
| 1 |
| 2 |
| 1 |
| 2 |
3,0,0,+
(或-
)
.| 1 |
| 2 |
| 1 |
| 2 |
(2)d的氢化物中心原子的杂化方式是
sp3
sp3
.(3)o元素所在族的符号是
ⅢB
ⅢB
.(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是
离子键,共价键,配位键
离子键,共价键,配位键
.(5)f、l、q的氢化物中沸点最高的是
HF
HF
.(写化学式)(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点
小于
小于
jc晶体的熔点(填“大于”“等于”“小于”)原因是因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高
因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高
.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①
(2)在①~?元素中,金属性最强的元素是
(3)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,请写出反应的化学方程式
(4)第三周期中原子半径最大的元素是
(5)元素③⑦与氢元素形成的一种化合物含有的化学键类型有
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
N
N
;⑥Si
Si
(2)在①~?元素中,金属性最强的元素是
K
K
,非金属性最强的元素是F
F
,最不活泼的元素是Ar
Ar
.(均填元素符号)(3)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
b
b
.a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,请写出反应的化学方程式
Cl2+Na2S=2NaCl+S
Cl2+Na2S=2NaCl+S
.(4)第三周期中原子半径最大的元素是
③
③
(填序号),跟它同周期原子半径最小的元素是⑧
⑧
(填序号),它们可以形成离子
离子
(填离子或共价)化合物.(5)元素③⑦与氢元素形成的一种化合物含有的化学键类型有
离子键和共价键
离子键和共价键
. 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J |
(1)写出下列元素的元素的符号:F
F
F
、JAr
Ar
.(2)G元素与E元素形成的化合物的化学式是
Na2O
Na2O
、Na2O2
Na2O2
,它们都是离子
离子
(填“离子”或“共价”)化合物.(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是
HClO4
HClO4
,属于两性氢氧化物的是Al(OH)3
Al(OH)3
(用化合物的化学式表示).(4)只含有A、C两种元素的化合物称为
烃
烃
,这些化合物中:①相对分子质量最小的是
CH4
CH4
,该化合物的分子空间构型是正四面体
正四面体
;②分子中含有双键,但原子数最少的是
CH2=CH2
CH2=CH2
,它与HCl反应的化学方程式为CH2=CH2+HCl→CH3CH2Cl
CH2=CH2+HCl→CH3CH2Cl
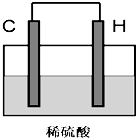
;(5)将H单质与C的一种单质(导体)按如图装置连接,该装置称为
原电池
原电池
.其中C极为正极
正极
,(填正负极)并写出该电极反应式为:2H++2e-=H2↑
2H++2e-=H2↑
.电子流动方向H流向C
H流向C
.