题目内容
下表为元素周期表的一部,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)请写出②的元素符号
(2)请写出③的最高价氧化物的电子式
 .
.
(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示)
(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
(6)⑦⑧两元素相比较,金属性较强的是
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
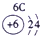
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
Be
Be
(2)请写出③的最高价氧化物的电子式


(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
Na>Al>F
Na>Al>F
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示)
HNO3>H2CO3>H2SiO3(或H4SiO4)
HNO3>H2CO3>H2SiO3(或H4SiO4)
.(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
NaOH+HClO4═NaClO4+H2O
NaOH+HClO4═NaClO4+H2O
(6)⑦⑧两元素相比较,金属性较强的是
镁
镁
(填名称),可以验证该结论的实验是(b)(c)
(b)(c)
(填编号).(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
分析:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为F,⑥为Na,⑦为Mg,⑧为Al,⑨为Si,⑩为Cl,结合元素周期律及非金属性、金属性的比较方法来解答.
解答:解:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为F,⑥为Na,⑦为Mg,⑧为Al,⑨为Si,⑩为Cl,
(1)由上述分析可知,②的元素符号为Be,故答案为:Be;
(2)③的最高价氧化物为二氧化碳,其电子式为 ,故答案为:
,故答案为: ;
;
(3)电子层越少,半径越小,在同周期,原子半径随原子序数的增大而减小,则⑤、⑥、⑧的原子半径由大到小的顺序为Na>Al>F,故答案为:Na>Al>F;
(4)非金属性越强,其最高价氧化物的水化物的酸性越强,则③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3(或H4SiO4),
故答案为:HNO3>H2CO3>H2SiO3(或H4SiO4);
(5)元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式为NaOH+HClO4═NaClO4+H2O,故答案为:NaOH+HClO4═NaClO4+H2O;
(6)镁的金属性大于铝的金属性,可利用金属与酸(或水)反应的快慢、金属单质之间的置换反应等来比较,
(a)将在空气中放置已久的这两种元素的块状单质表面均被氧化,分别放入热水中,现象不明显,不能比较金属性,故不选;
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,Mg反应剧烈,Mg的金属性强,故选;
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液,Mg反应后溶液变红,Mg的金属性强,故选;
(d)金属元素,不能比较这两种元素的气态氢化物的稳定性,故不选;
故答案为:镁;(b)(c).
(1)由上述分析可知,②的元素符号为Be,故答案为:Be;
(2)③的最高价氧化物为二氧化碳,其电子式为
 ,故答案为:
,故答案为: ;
;(3)电子层越少,半径越小,在同周期,原子半径随原子序数的增大而减小,则⑤、⑥、⑧的原子半径由大到小的顺序为Na>Al>F,故答案为:Na>Al>F;
(4)非金属性越强,其最高价氧化物的水化物的酸性越强,则③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3(或H4SiO4),
故答案为:HNO3>H2CO3>H2SiO3(或H4SiO4);
(5)元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式为NaOH+HClO4═NaClO4+H2O,故答案为:NaOH+HClO4═NaClO4+H2O;
(6)镁的金属性大于铝的金属性,可利用金属与酸(或水)反应的快慢、金属单质之间的置换反应等来比较,
(a)将在空气中放置已久的这两种元素的块状单质表面均被氧化,分别放入热水中,现象不明显,不能比较金属性,故不选;
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,Mg反应剧烈,Mg的金属性强,故选;
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液,Mg反应后溶液变红,Mg的金属性强,故选;
(d)金属元素,不能比较这两种元素的气态氢化物的稳定性,故不选;
故答案为:镁;(b)(c).
点评:本题考查位置、结构、性质的关系及应用,元素的推断是解答本题的关键,注重规律性知识的考查,明确金属性、非金属性的比较及元素周期律即可解答,题目难度中等.

练习册系列答案
 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目









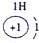
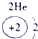
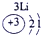
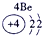
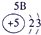
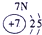
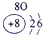
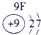
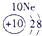
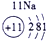





 表示的是
表示的是