摘要:B 解析:溶液的酸碱度用pH来表示.pH的范围通常在 0-14 .当pH=7时.溶液呈 中 性,当pH>7时.溶液呈 碱 性.并且pH越大.碱性越 强 ,当pH<7时.溶液呈 酸 性.并且pH越小.酸性越 强 .
网址:http://m.1010jiajiao.com/timu3_id_7568[举报]
(2013?广陵区一模)牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:
[资料卡片]:
a、SiO2不溶于水、且不与酸反应,高温不分解;
b、NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c、牙膏中保湿剂、增稠剂、香精等均为有机物.
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显
(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象.资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是
(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
[实验步骤]:
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至室温;
②转移剩余物至烧杯中,加入稀HCl,至
③过滤、洗涤、称量得到剩余固体质量(如表);
④根据实验数据进行计算.
[数据处理]:
(4)此测定做3次实验的目的是
(5)综合上述实验方案及实验数据,计算此牙膏中SiO2的质量分数.
[实验分析]:
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是
(7)高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去
(8)步骤②中,加稀HCl发生的反应有
(9)步骤③中,洗涤的目的是
(10)为保证洗涤效果,最好用
A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液.
查看习题详情和答案>>
 |
配料表 |
| 摩擦剂:SiO2(20%) CaCO3(少量) 清洁剂:NaHCO3(15%) 发泡剂:K12(极少量) 保湿剂:甘油等(60%) 增稠剂:卡拉胶等 其他:香精、水等 |
a、SiO2不溶于水、且不与酸反应,高温不分解;
b、NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c、牙膏中保湿剂、增稠剂、香精等均为有机物.
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显
碱
碱
性,实验室能否用pH试纸测得该数值,请你作出判断并说明理由.不能,因为pH试纸只能测定出整数值
不能,因为pH试纸只能测定出整数值
;(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象.资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是
K12的溶解度随温度降低而降低(或随温度升高而增大)
K12的溶解度随温度降低而降低(或随温度升高而增大)
;(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
[实验步骤]:
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至室温;
②转移剩余物至烧杯中,加入稀HCl,至
气体不再产生为止
气体不再产生为止
;③过滤、洗涤、称量得到剩余固体质量(如表);
| 实验编号 | 1 | 2 | 3 |
| 实验前(g) | 2.00 | 2.00 | 2.00 |
| 实验后(g) | 0.43 | 0.44 | 0.45 |
[数据处理]:
(4)此测定做3次实验的目的是
提高实验的精确度(或可信度)
提高实验的精确度(或可信度)
;(5)综合上述实验方案及实验数据,计算此牙膏中SiO2的质量分数.
22%
22%
;[实验分析]:
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是
步骤③中,没有将剩余固体进行干燥,有洗涤液附着在固体表面
步骤③中,没有将剩余固体进行干燥,有洗涤液附着在固体表面
;(7)高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去
保湿剂、增稠剂、香精等有机物
保湿剂、增稠剂、香精等有机物
;(8)步骤②中,加稀HCl发生的反应有
CaO+2HCl═CaCl2+H2O
CaO+2HCl═CaCl2+H2O
、Na2CO3+2HCl═2NaCl+H2O+CO2↑
Na2CO3+2HCl═2NaCl+H2O+CO2↑
;(9)步骤③中,洗涤的目的是
除去固体表面附着的CaCl2和NaCl溶液
除去固体表面附着的CaCl2和NaCl溶液
;若不洗涤,则测定结果将偏大
偏大
.(填“偏大”、“偏小”或“不变”)(10)为保证洗涤效果,最好用
A
A
洗涤.A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液.
海洋是个巨大的宝库,为人类提供了宝贵的自然资源.
(1)食用海鱼摄取的主要营养素是 .
(2)如图1为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 .
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发、结晶,制得粗盐.
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为 g.
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
(5)从海水中提取溴常用吹出法,即用氯气将海水里的溴化钠中的溴置换出来,再用空气或水蒸气吹出溴.流程示意图如图2:
①写出氯气置换出溴单质的化学方程式; ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是 .
 查看习题详情和答案>>
查看习题详情和答案>>
(1)食用海鱼摄取的主要营养素是 .
(2)如图1为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 .
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发、结晶,制得粗盐.
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为 g.
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
①写出氯气置换出溴单质的化学方程式; ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是 .
 查看习题详情和答案>>
查看习题详情和答案>>
海洋是个巨大的宝库,为人类提供了宝贵的自然资源.
(1)食用海鱼摄取的主要营养素是________.
(2)如图1为海水淡化装置,利用的能源是________,获得的蒸馏水属于________.
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量________溶液除去CaCl2和过量的BaCl2,生成的沉淀经________除去,最后加入________调节pH,蒸发、结晶,制得粗盐.
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为________g.
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
①写出氯气置换出溴单质的化学方程式;________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是________.
 查看习题详情和答案>>
查看习题详情和答案>>
海洋是个巨大的宝库,为人类提供了宝贵的自然资源。
(1)食用海鱼摄取的主要营养素是 。
(2)右图为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 (填字母序号)。
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品。用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 ,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发,结晶,制得精盐。
(4)用氯化钠和碳酸氢铵NH4HCO3可制备碳酸氢钠和氯化铵NH4Cl,该反应化学方程式可表示为:NaCl+ NH4HCO3=NaHCO3+NH4Cl。
20℃时,按上述化学方程式中反应物的质量比,向100 g水中加入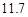 g NaCl和
g NaCl和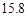 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 溶解度/g |  | 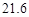 |  | 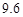 |
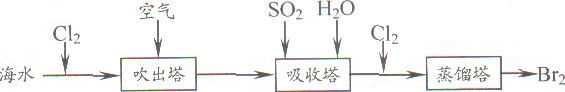
①写出氯气置换出溴单质的化学方程式: ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度。
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O==H2SO4+2HBr)。根据流程图分析,通入SO2的目的是 。 查看习题详情和答案>>
海洋是个巨大的宝库,为人类提供了宝贵的自然资源。
(1)食用海鱼摄取的主要营养素是 。
(2)右图为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 (填字母序号)。

A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品。用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 ,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发,结晶,制得精盐。
(4)用氯化钠和碳酸氢铵NH4HCO3可制备碳酸氢钠和氯化铵NH4Cl,该反应化学方程式可表示为:NaCl+ NH4HCO3=NaHCO3+NH4Cl。
20℃时,按上述化学方程式中反应物的质量比,向100 g水中加入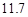 g NaCl和
g NaCl和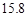 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
(5)从海水中提取溴常用吹出法,即用氯气(C12)将海水里溴化钠(NaBr)中的溴置换出来,再用空气或水蒸气吹出溴(Br2)。流程示意图如下:
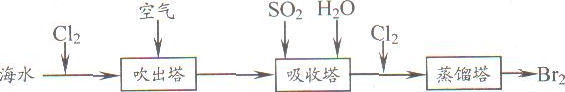
①写出氯气置换出溴单质的化学方程式: ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度。
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O==H2SO4+2HBr)。根据流程图分析,通入SO2的目的是 。
(1)食用海鱼摄取的主要营养素是 。
(2)右图为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 (填字母序号)。

A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品。用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 ,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发,结晶,制得精盐。
(4)用氯化钠和碳酸氢铵NH4HCO3可制备碳酸氢钠和氯化铵NH4Cl,该反应化学方程式可表示为:NaCl+ NH4HCO3=NaHCO3+NH4Cl。
20℃时,按上述化学方程式中反应物的质量比,向100 g水中加入
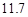 g NaCl和
g NaCl和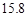 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 溶解度/g |  | 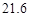 | 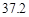 | 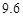 |

①写出氯气置换出溴单质的化学方程式: ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度。
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O==H2SO4+2HBr)。根据流程图分析,通入SO2的目的是 。