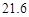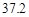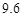题目内容
海洋是个巨大的宝库,为人类提供了宝贵的自然资源.
(1)食用海鱼摄取的主要营养素是________.
(2)如图1为海水淡化装置,利用的能源是________,获得的蒸馏水属于________.
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量________溶液除去CaCl2和过量的BaCl2,生成的沉淀经________除去,最后加入________调节pH,蒸发、结晶,制得粗盐.
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为________g.
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
①写出氯气置换出溴单质的化学方程式;________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是________.

(2)从图中可以得出使用的为太阳能;而得到的蒸馏水为纯净物,故选B;
(3)粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量Na2CO3溶液除去CaCl2和过量的BaCl2,生成的沉淀经CaCO3、BaCO3除去,最后加入稀盐酸调节pH等于7,蒸发、结晶,制得粗盐;
(4)根据化学方程式中质量关系可以知道:
NaCl+NH4HCO3═NaHCO3+NH4Cl
58.5 79 84 53.5
11.7g 15.8g 16.8g 10.7g
满足化学式中相对分子质量的关系,故可以知道可以得到碳酸氢钠的质量为16.8g,生成氯化铵的质量为10.7g,根据题中的溶解度表可以知道,20℃时100g水中能够溶解碳酸氢钠的质量为9.6g,能够溶解氯化铵的质量为37.2g,所以能够析出的晶体的质量为16.8g-9.6g=7.2g.
(5)由题干叙述可知氯气和溴化钠可以置换出溴单质,反应的化学方程式为:Cl2+2NaBr=2NaCl+Br2,常见的测定溶液酸碱度的方法是使用pH试纸测定溶液的酸碱度,由于吸收塔中发生的反应是Br2+S02+2H20═H2S04+2HBr.所以,加入二氧化硫的目的是使溴与空气相互分离.
故答案为:(1)蛋白质;(2)太阳能,B;(3)Na2CO3,CaCO3、BaCO3,稀盐酸;(4)7.2; (5)①Cl2+2NaBr=2NaCl+Br2;pH试纸 ②分离溴与空气.
分析:(1)鱼类中含有较多的蛋白质,可以据此解答;
(2)从图中可以得出使用的为太阳能,而得到的水为纯净物,可以据此解答;
(3)根据硫酸根离子用钡离子沉淀,钡离子、钙离子用碳酸根离子沉淀,最后用稀盐酸调节溶液的pH为7.除掉碳酸根离子得到氯化钠溶液,通过蒸发的到氯化钠晶体.
(4)根据质量守恒定律进行解答;
(5)依据题干叙述书写氯气置换出溴单质的化学方程式,并根据常见的测定溶液酸碱度的方法测定溶液的酸碱度,依据吸收塔中发生的反应分析加入二氧化硫的目的;
点评:要想解答好这类题目,首先,要理解和熟记对海洋资源的合理开发与利用,以及与之相关的知识.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

海洋是个巨大的宝库,为人类提供了宝贵的自然资源。
(1)食用海鱼摄取的主要营养素是 。
(2)右图为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 (填字母序号)。
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品。用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 ,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发,结晶,制得精盐。
(4)用氯化钠和碳酸氢铵NH4HCO3可制备碳酸氢钠和氯化铵NH4Cl,该反应化学方程式可表示为:NaCl+ NH4HCO3=NaHCO3+NH4Cl。
20℃时,按上述化学方程式中反应物的质量比,向100 g水中加入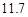 g NaCl和
g NaCl和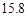 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 溶解度/g |  | 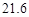 |  | 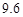 |
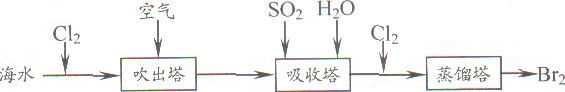
①写出氯气置换出溴单质的化学方程式: ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度。
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O==H2SO4+2HBr)。根据流程图分析,通入SO2的目的是 。
海洋是个巨大的宝库,为人类提供了宝贵的自然资源。
(1)食用海鱼摄取的主要营养素是 。
(2)右图为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 (填字母序号)。

A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品。用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 ,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发,结晶,制得精盐。
(4)用氯化钠和碳酸氢铵NH4HCO3可制备碳酸氢钠和氯化铵NH4Cl,该反应化学方程式可表示为:NaCl+ NH4HCO3=NaHCO3+NH4Cl。
20℃时,按上述化学方程式中反应物的质量比,向100 g水中加入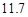 g
NaCl和
g
NaCl和 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
|
物质 |
NaCl |
NH4HCO3 |
NH4Cl |
NaHCO3 |
|
溶解度/g |
|
|
|
|
(5)从海水中提取溴常用吹出法,即用氯气(C12)将海水里溴化钠(NaBr)中的溴置换出来,再用空气或水蒸气吹出溴(Br2)。流程示意图如下:
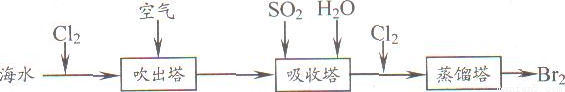
①写出氯气置换出溴单质的化学方程式: ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度。
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O==H2SO4+2HBr)。根据流程图分析,通入SO2的目的是 。
(1)食用海鱼摄取的主要营养素是 .
(2)如图1为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 .
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发、结晶,制得粗盐.
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为 g.
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
①写出氯气置换出溴单质的化学方程式; ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是 .