摘要:1349.工业生产的纯碱中常含有少量的NaCl等杂质.如图所示是测定产品中Na2CO3质量分数的实验装置.实验操作步骤有: A.在干燥管内填满碱石灰.质量为mg(碱石灰易吸收CO2和H2O), B.取ng样品装入广口瓶中, C.检查装置的气密性, D.缓缓鼓入空气数分钟.再称干燥管质量为wg, E.关闭止水夹, F.打开止水夹, G.缓缓加入稀硫酸至不再产生气体为止, H.缓缓鼓入空气数分钟. (1)正确的操作顺序是: C→___→F→___→E→___→G→____→D. (2)操作步骤D中.要缓缓鼓入空气数分钟.鼓入空气的作用是_____,装置甲的作用是_____,装置乙的作用是______. (3)计算溶液中Na2CO3质量分数的计算式为__________. (4)若去掉装置甲.测定结果会(填“偏大 .“偏小 或“无影响 .下同)______.若去掉装置乙.测定结果会________.
网址:http://m.1010jiajiao.com/timu3_id_74120[举报]
 工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.(1)甲装置的作用是
吸收空气中的二氧化碳
吸收空气中的二氧化碳
;丙装置的作用是吸收二氧化碳中的水蒸气
吸收二氧化碳中的水蒸气
.(2)乙装置反应完成后,打开甲和乙之间的铁夹,通数分钟空气的作用是
排出装置中的二氧化碳气体,使之都被丁处碱石灰完全吸收
排出装置中的二氧化碳气体,使之都被丁处碱石灰完全吸收
.写出甲装置中发生反应的离子方程式(NaOH溶液足量):CO2+2OH-=CO32-+H2O
CO2+2OH-=CO32-+H2O
.(3)若去掉戊装置,测得的CO2质量会
偏大
偏大
(填“偏大”或“偏小”).(4)若取n g样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为m g,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为
| 53(w-m) |
| 22n |
| 53(w-m) |
| 22n |
工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用下图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
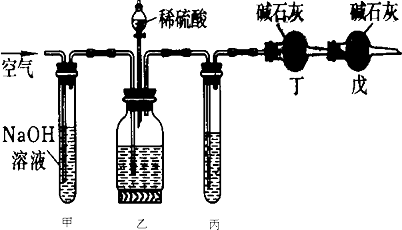
(1)装稀硫酸的装置名称 .
(2)甲装置的作用是 ;戊装置的作用是 .
(3)乙装置反应前先通数分钟空气的作用是 ,甲装置反应的离子方程式是 .
(4)丙装置中试剂是 若去掉丙装置,测得纯碱的质量分数会 (填“偏大”或“偏小”).
(5)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为 .
查看习题详情和答案>>

(1)装稀硫酸的装置名称
(2)甲装置的作用是
(3)乙装置反应前先通数分钟空气的作用是
(4)丙装置中试剂是
(5)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为
工业生产的纯碱中常含有少量的NaCl等杂质。图1-9是测定产品中Na2CO3质量分数的实验装置。实验操作步骤有:

图1-9
(A)在干燥管内填满碱石灰,总质量为m g;
(B)取n g样品装入广口瓶中;
(C)检验装置的气密性;
(D)缓缓鼓入空气数分钟,再称干燥管总质量为w g;
(E)关闭止水夹;
(F)打开止水夹;
(G)缓缓加入稀硫酸至不再产生气体为止;
(H)缓缓鼓入空气数分钟。
(1)正确的操作顺序是(填写序号):C→_______→F________→E_______→G________→D。
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是________________;装置甲的作用是________________;装置乙的作用是________________。
(3)计算溶液中Na2CO3质量分数的计算式为_____________________________________。
(4)若去掉装置甲,测定结果会________;若去掉装置乙,测定结果会________。(填“偏大”“偏小”或“无影响”)。
查看习题详情和答案>>工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用下图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
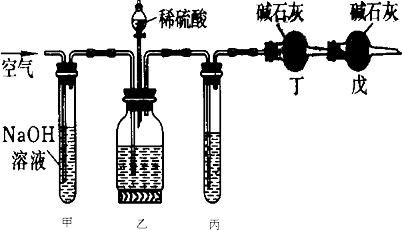
(1)装稀硫酸的装置名称______.
(2)甲装置的作用是______;戊装置的作用是______.
(3)乙装置反应前先通数分钟空气的作用是______,甲装置反应的离子方程式是______.
(4)丙装置中试剂是______若去掉丙装置,测得纯碱的质量分数会______(填“偏大”或“偏小”).
(5)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为______.
查看习题详情和答案>>
工业生产的纯碱中常含有少量的NaCl杂质。某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用下图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数。

(1)甲装置的作用是____________;甲装置反应的离子方程式是__________________________。
(2)乙装置反应结束后,再通数分钟空气的作用是___________________。
(3)若去掉丙装置,测得的CO2质量会_________(填“偏大”、“偏小”或“无影响”)。
(4)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为_____________________。
(5)有同学认为在丁后面还要加一装置,请分析完成装置图于方框中。
查看习题详情和答案>>
(2)乙装置反应结束后,再通数分钟空气的作用是___________________。
(3)若去掉丙装置,测得的CO2质量会_________(填“偏大”、“偏小”或“无影响”)。
(4)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为_____________________。
(5)有同学认为在丁后面还要加一装置,请分析完成装置图于方框中。