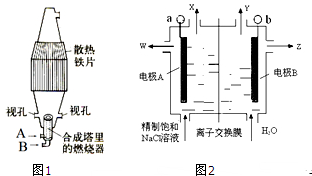
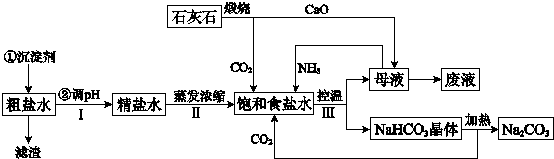
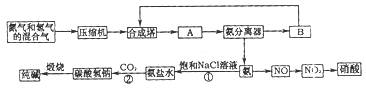
题目内容
工业生产的纯碱中常含有少量的NaCl杂质。某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用下图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数。
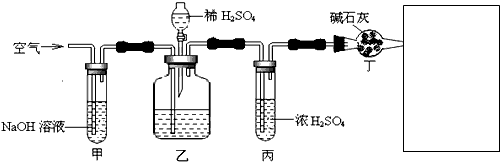
(1)甲装置的作用是____________;甲装置反应的离子方程式是__________________________。
(2)乙装置反应结束后,再通数分钟空气的作用是___________________。
(3)若去掉丙装置,测得的CO2质量会_________(填“偏大”、“偏小”或“无影响”)。
(4)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为_____________________。
(5)有同学认为在丁后面还要加一装置,请分析完成装置图于方框中。
(2)乙装置反应结束后,再通数分钟空气的作用是___________________。
(3)若去掉丙装置,测得的CO2质量会_________(填“偏大”、“偏小”或“无影响”)。
(4)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为_____________________。
(5)有同学认为在丁后面还要加一装置,请分析完成装置图于方框中。
(1)除去空气中的CO2等气体,减小误差;CO2+2OH-==CO32-+H2O
(2)将产生的CO2全部被干燥管里的碱石灰吸收
(3)偏大
(4)
(5)
(2)将产生的CO2全部被干燥管里的碱石灰吸收
(3)偏大
(4)

(5)


练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
对工业上的“三酸二碱”(硝酸、盐酸、硫酸、纯碱和烧碱),下列有关说法不正确的是( )
| A、室温下在浓硝酸、浓盐酸和浓硫酸中分别投入光亮的铁钉,在盐酸中溶解最快 | B、在氯碱工业中,产物烧碱在阴极区得到,两极气态产物可用于合成盐酸 | C、纯碱可用于生产普通玻璃;硝酸可用于制化肥和炸药等 | D、工业盐酸和工业硝酸都常呈黄色,因所含杂质完全相同 |
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
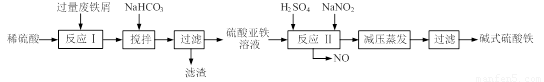
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。