摘要:6.“侯氏制碱法 的生产过程简单示意如下: 对此生产过程的优点下列评论不正确的是 (A)生产过程中的部分产品又为起始原料用.(B)副产品为氮肥. 副产品无污染 [答案和提示]
网址:http://m.1010jiajiao.com/timu3_id_7411[举报]
烟台是美丽的海滨城市,有较长的海岸线,海洋资源十分丰富.以下是我市对海水资源的部分利用.
(1)海水中含量最高的盐是
(2)从晒盐后的卤水中提取重要金属镁.提取镁的步骤如下:

提取Mg的过程中,试剂A最好选用
(3)我国化工专家侯德榜先生发明的侯氏制碱法的基本原理是在浓氨水中通入足量的CO2生成一种盐,然后在此溶液中加入细小食盐粉末.由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于NaHCO3不稳定,加热后生成纯碱、水和二氧化碳.根据以上叙述简要回答问题:
①用上述方法进行生产时,所用的起始原料为
②最终产品是
③有关的化学方程式是
④该生产过程中没有涉及的基本反应类型是
⑤有人认为侯氏制碱法的优点有如下四点:
A.生产过程中部分产品可选为起始原料使用
B.副产品是一种可利用的氮肥
C.副产物不会造成环境污染
D.反应不需要加热
你认为其中正确的是
查看习题详情和答案>>
(1)海水中含量最高的盐是
氯化钠
氯化钠
,海水经蒸发
蒸发
结晶可获得粗盐.(2)从晒盐后的卤水中提取重要金属镁.提取镁的步骤如下:

提取Mg的过程中,试剂A最好选用
Ca(OH)2
Ca(OH)2
(从我市有丰富的石灰石资源考虑),试剂B选用稀盐酸
稀盐酸
.(3)我国化工专家侯德榜先生发明的侯氏制碱法的基本原理是在浓氨水中通入足量的CO2生成一种盐,然后在此溶液中加入细小食盐粉末.由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于NaHCO3不稳定,加热后生成纯碱、水和二氧化碳.根据以上叙述简要回答问题:
①用上述方法进行生产时,所用的起始原料为
NH3、CO2、NaCl
NH3、CO2、NaCl
(写出化学式,下同).②最终产品是
Na2CO3、NH4Cl
Na2CO3、NH4Cl
.③有关的化学方程式是
NH3+H2O+CO2═NH4HCO3
NH3+H2O+CO2═NH4HCO3
;NH4HCO3+NaCl═NH4Cl+NaHCO3
NH4HCO3+NaCl═NH4Cl+NaHCO3
;2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
.
| ||
④该生产过程中没有涉及的基本反应类型是
置换反应
置换反应
.⑤有人认为侯氏制碱法的优点有如下四点:
A.生产过程中部分产品可选为起始原料使用
B.副产品是一种可利用的氮肥
C.副产物不会造成环境污染
D.反应不需要加热
你认为其中正确的是
ABC
ABC
(选填字母序号).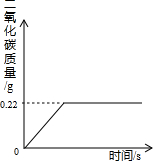 在“侯氏制碱法”的工艺流程中,最后一步是用加热NaHCO3的方法来制取纯碱的,某纯碱生产制得的产品Na2CO3混有少量NaHCO3,为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3=Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成CO2气体的质量与反应时间的关系如图所示:
在“侯氏制碱法”的工艺流程中,最后一步是用加热NaHCO3的方法来制取纯碱的,某纯碱生产制得的产品Na2CO3混有少量NaHCO3,为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3=Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成CO2气体的质量与反应时间的关系如图所示:请解答下列问题:
(1)反应过程中生成CO2的质量
(2)100g混合物中NaHCO3的质量;
(3)混合物中Na2CO3的质量分数. 查看习题详情和答案>>
Ⅰ.纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室模拟侯氏制碱法生产原理的主要过程:
①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na2CO3,同时生成的CO2可以循环利用;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
(1)请写出步骤②和③的化学方程式.
②: ;③: .
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥.该化合物遇碱会生成有刺激性气味的气体 (写化学式,下同),此气体可使紫色石蕊试液变蓝,以上反应现象可用于检验氯化铵中的阳离子.若要通过实验区分氯化铵和另一种氮肥硝酸铵,常用的试剂是 溶液.
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去).
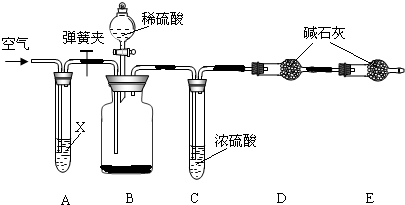
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g.
试回答:
(1)鼓入空气的目的是 ,装置A中试剂X最适宜选用 .
(2)若没有C装置,则会导致测定结果 (填“偏大”或“偏小”).
(3)E装置的作用是 .
(4)请根据实验中测得的有关数据,纯碱样品中碳酸钠的质量分数为 (结果保留一位小数 ).
查看习题详情和答案>>
①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na2CO3,同时生成的CO2可以循环利用;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
(1)请写出步骤②和③的化学方程式.
②:
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥.该化合物遇碱会生成有刺激性气味的气体
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去).

实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g.
试回答:
(1)鼓入空气的目的是
(2)若没有C装置,则会导致测定结果
(3)E装置的作用是
(4)请根据实验中测得的有关数据,纯碱样品中碳酸钠的质量分数为
Ⅰ.纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:
①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
(1)请写出步骤②和③的化学方程式.
②: ;
③: .
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥.该化合物遇碱会生成有刺激性气味的气体 (写化学式,下同),此气体可使紫色石蕊试液变蓝,以上反应现象可用于检验氯化铵中的阳离子.若要通过实验区分氯化铵和另一种氮肥硝酸铵,常用的试剂是 溶液,请比较这两种氮肥中氮元素的质量分数:氯化铵 硝酸铵(选填“>”、“<”或“=”).
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去).

实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g.
试回答:
(1)鼓入空气的目的是 ,装置A中试剂X最适宜选用 .
(2)若没有C装置,则会导致测定结果 (填“偏大”或“偏小”).
(3)E装置的作用是 .
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数.(要求:写出计算过程,结果保留一位小数) 查看习题详情和答案>>
①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
(1)请写出步骤②和③的化学方程式.
②:
③:
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥.该化合物遇碱会生成有刺激性气味的气体
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去).

实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g.
试回答:
(1)鼓入空气的目的是
(2)若没有C装置,则会导致测定结果
(3)E装置的作用是
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数.(要求:写出计算过程,结果保留一位小数) 查看习题详情和答案>>
我国化工专家侯德榜先生发明的“侯氏制碱法”的基本原理是:在浓氨水中通入足量的二氧化碳生成一种盐,然后在此溶液中加入细小的食盐粉末;由于碳酸氢钠在该状态下溶解度很小,呈晶体析出,同时由于碳酸氢钠不稳定,加热后生成纯碱.水和二氧化碳;再向析出碳酸氢钠后的氯化铵溶液中加入食盐,使其中的氯化铵单独结晶出来,氯化钠则可循环使用.根据以上叙述简要回答问题:
(1)用上述方法进行实验时,所用的起始原料 .(写出它们的化学式,下同).
(2)最终产品是 .
(3)有关的化学方程式 ; ; .
(4)有人认为侯氏制碱法的优点有以下四点:
A.生产过程中部分产品可作为起始原料使用;
B.副产品是一种可利用的氮肥;
C.反应不需要加热;
D.副产品不会造成环境污染.
你认为其中正确的是(用代号回答) .
查看习题详情和答案>>
(1)用上述方法进行实验时,所用的起始原料
(2)最终产品是
(3)有关的化学方程式
(4)有人认为侯氏制碱法的优点有以下四点:
A.生产过程中部分产品可作为起始原料使用;
B.副产品是一种可利用的氮肥;
C.反应不需要加热;
D.副产品不会造成环境污染.
你认为其中正确的是(用代号回答)