题目内容
烟台是美丽的海滨城市,有较长的海岸线,海洋资源十分丰富.以下是我市对海水资源的部分利用.
(1)海水中含量最高的盐是
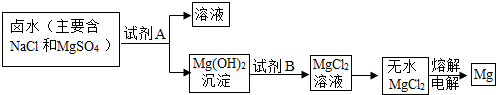
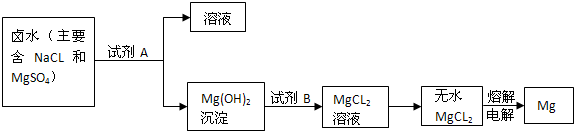
(2)从晒盐后的卤水中提取重要金属镁.提取镁的步骤如下:

提取Mg的过程中,试剂A最好选用
(3)我国化工专家侯德榜先生发明的侯氏制碱法的基本原理是在浓氨水中通入足量的CO2生成一种盐,然后在此溶液中加入细小食盐粉末.由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于NaHCO3不稳定,加热后生成纯碱、水和二氧化碳.根据以上叙述简要回答问题:
①用上述方法进行生产时,所用的起始原料为
②最终产品是
③有关的化学方程式是
④该生产过程中没有涉及的基本反应类型是
⑤有人认为侯氏制碱法的优点有如下四点:
A.生产过程中部分产品可选为起始原料使用
B.副产品是一种可利用的氮肥
C.副产物不会造成环境污染
D.反应不需要加热
你认为其中正确的是
(1)海水中含量最高的盐是
氯化钠
氯化钠
,海水经蒸发
蒸发
结晶可获得粗盐.(2)从晒盐后的卤水中提取重要金属镁.提取镁的步骤如下:

提取Mg的过程中,试剂A最好选用
Ca(OH)2
Ca(OH)2
(从我市有丰富的石灰石资源考虑),试剂B选用稀盐酸
稀盐酸
.(3)我国化工专家侯德榜先生发明的侯氏制碱法的基本原理是在浓氨水中通入足量的CO2生成一种盐,然后在此溶液中加入细小食盐粉末.由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于NaHCO3不稳定,加热后生成纯碱、水和二氧化碳.根据以上叙述简要回答问题:
①用上述方法进行生产时,所用的起始原料为
NH3、CO2、NaCl
NH3、CO2、NaCl
(写出化学式,下同).②最终产品是
Na2CO3、NH4Cl
Na2CO3、NH4Cl
.③有关的化学方程式是
NH3+H2O+CO2═NH4HCO3
NH3+H2O+CO2═NH4HCO3
;NH4HCO3+NaCl═NH4Cl+NaHCO3
NH4HCO3+NaCl═NH4Cl+NaHCO3
;2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
.
| ||
④该生产过程中没有涉及的基本反应类型是
置换反应
置换反应
.⑤有人认为侯氏制碱法的优点有如下四点:
A.生产过程中部分产品可选为起始原料使用
B.副产品是一种可利用的氮肥
C.副产物不会造成环境污染
D.反应不需要加热
你认为其中正确的是
ABC
ABC
(选填字母序号).分析:(1)根据海水中含量最高的盐为氯化钠及海水晒盐的原理来解答;
(2)根据题中信息该市含有较丰富的石灰石资源结合加入试剂A后得到产物可以完成解答;
(3)由题给的信息可以判断,原料就是浓氨水、二氧化碳和NaCl;最终产物就是NH4Cl和Na2CO3;三个化学方程式也可很容易的写出来.可以据此完成该题的解答.
(2)根据题中信息该市含有较丰富的石灰石资源结合加入试剂A后得到产物可以完成解答;
(3)由题给的信息可以判断,原料就是浓氨水、二氧化碳和NaCl;最终产物就是NH4Cl和Na2CO3;三个化学方程式也可很容易的写出来.可以据此完成该题的解答.
解答:解:(1)海水中含量最多的盐是氯化钠;从海水中提取盐最常用的方法是蒸发;
(2)该市含有较丰富的石灰石资源,而锻烧石灰石可以得到氧化钙,而氧化钙溶于水可制得氢氧化钙溶液,所以A试剂应是氢氧化钙溶液,该实验流程如下:向NaCl、MgSO4的混合溶液中加入试剂A即Ca(OH)2后可得到Mg(OH)2沉淀,向Mg(OH)2沉淀中加入B,即稀盐酸可得到MgCl2溶液,所以试剂B为稀盐酸;
(3)①由“侯氏制碱法”的基本原理可知:首先是浓氨水和二氧化碳反应生成一种盐(NH4HCO3),在盐溶液中加入细小的食盐粉末,析出碳酸氢钠,碳酸氢钠不稳定,加热后生成纯碱(Na2CO3)、水和二氧化碳,部分原料可以循环使用.通过分析可知进行实验时,所用的起始原料为:NH3、CO2、NaCl.
②由实验原理可知:发生的反应有 NH3+H2O+CO2═NH4HCO3,NH4HCO3+NaCl═NH4Cl+NaHCO3;2NaHCO3
Na2CO3+CO2↑+H2O 所以最终产品是Na2CO3、NH4Cl;
③由②的分析可知实验过程中发生的反应有:NH3+H2O+CO2═NH4HCO3,NH4HCO3+NaCl═NH4Cl+NaHCO3;2NaHCO3
Na2CO3+CO2↑+H2O;
④分析③中所写的化学方程式可以知道为化合反应,为复分解反应,为分解反应,所以没出现的反应为置换反应;
⑤A、由(2)的分析可知反应生成的CO2可以循环作为起始原料使用,故A正确;
B、因为副产品(NH4Cl)含有氮元素(N)属于氮肥,故B正确;
C、因为副产品是NH4Cl、CO2、H2O 都不污染环境,,故C正确;
D、因为2NaHCO3
Na2CO3+CO2↑+H2O 这个反应需要加热故D错;所以应选ABC.
故答案为:(1)氯化钠;蒸发;
(2)Ca(OH)2;稀盐酸;
(3)①NH3、CO2、NaCl;
②Na2CO3、NH4Cl;
③NH3+H2O+CO2═NH4HCO3,NH4HCO3+NaCl═NH4Cl+NaHCO3;2NaHCO3
Na2CO3+CO2↑+H2O;
④置换反应;
⑤ABC.
(2)该市含有较丰富的石灰石资源,而锻烧石灰石可以得到氧化钙,而氧化钙溶于水可制得氢氧化钙溶液,所以A试剂应是氢氧化钙溶液,该实验流程如下:向NaCl、MgSO4的混合溶液中加入试剂A即Ca(OH)2后可得到Mg(OH)2沉淀,向Mg(OH)2沉淀中加入B,即稀盐酸可得到MgCl2溶液,所以试剂B为稀盐酸;
(3)①由“侯氏制碱法”的基本原理可知:首先是浓氨水和二氧化碳反应生成一种盐(NH4HCO3),在盐溶液中加入细小的食盐粉末,析出碳酸氢钠,碳酸氢钠不稳定,加热后生成纯碱(Na2CO3)、水和二氧化碳,部分原料可以循环使用.通过分析可知进行实验时,所用的起始原料为:NH3、CO2、NaCl.
②由实验原理可知:发生的反应有 NH3+H2O+CO2═NH4HCO3,NH4HCO3+NaCl═NH4Cl+NaHCO3;2NaHCO3
| ||
③由②的分析可知实验过程中发生的反应有:NH3+H2O+CO2═NH4HCO3,NH4HCO3+NaCl═NH4Cl+NaHCO3;2NaHCO3
| ||
④分析③中所写的化学方程式可以知道为化合反应,为复分解反应,为分解反应,所以没出现的反应为置换反应;
⑤A、由(2)的分析可知反应生成的CO2可以循环作为起始原料使用,故A正确;
B、因为副产品(NH4Cl)含有氮元素(N)属于氮肥,故B正确;
C、因为副产品是NH4Cl、CO2、H2O 都不污染环境,,故C正确;
D、因为2NaHCO3
| ||
故答案为:(1)氯化钠;蒸发;
(2)Ca(OH)2;稀盐酸;
(3)①NH3、CO2、NaCl;
②Na2CO3、NH4Cl;
③NH3+H2O+CO2═NH4HCO3,NH4HCO3+NaCl═NH4Cl+NaHCO3;2NaHCO3
| ||
④置换反应;
⑤ABC.
点评:要想解答好这类题目,首先,要理解和熟记对海洋资源的合理开发与利用,以及与之相关的知识.然后,根据所给的问题情景结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目