摘要:已知用金属钠得到氧化钠.有多种方法: ①4Na + O2 == 2Na2O ②4Na + CO2 == 2Na2O + C ③2NaNO2 + 6Na == 4Na2O + N2↑ 在上述三种方法中最好的方法是 .原因是 .
网址:http://m.1010jiajiao.com/timu3_id_73918[举报]
CO和H2是合成多种有机化合物的重要原料,亦称作合成气.CO和H2反应在不同条件下得到不同的产物:
现有可以由CO和H2在不同条件下合成的A、C、G三种有机化合物,这三种化合物在上表中都已列出.它们及相关的其他物质有如下的转化关系:

已知:常温常压下,A、B、D均为气态,E和F是同分异构体,将等质量的D和E分别完全燃烧消耗氧气的量、生成二氧化碳和水的量两者都相同.请回答下列问题:
(1)写出D和H的结构简式:D ,H ;写出由B生成C的反应类型 .
(2)G与过量金属钠反应的化学方程式为 .
(3)F的银镜反应为 .
(4)C可用作燃料电池的燃料,在碱性溶液中此电池负极的电极反应为 .
(5)A与水蒸气在一定条件下反应生成合成气CO和H2,其热化学方程式为(注明催化剂) ,为了有利于合成气的生成,压强不采用高压而采用常压的原因是 ,温度应高于 .
查看习题详情和答案>>
| 反应条件 | 主要产物 | 生成1mol有机物 △H/kJ?mol-1 |
| Cu-ZnO-Cr2O3-MnO,200~400℃,30~40MPa | 甲醇 | -128 |
| Ni,250~500℃,常压 | 甲烷(和水蒸气) | -206.2 |
| FeO-Co-Ni,150~350℃,0.1~3MPa | 人造石油 | |
| Ru,150~250℃,10~100MPa | 固态烷烃 | |
| ThO-ZnO-Al2O3,400~500℃,10~100MPa | 异丁烷、异戊烷 | |
| Co-Fe,100~200℃,10~20MPa | 含氧有机化合物 | |
| Rh原子簇配合物,高压液相 | 乙二醇 (少量乙酸、乙醇) |

已知:常温常压下,A、B、D均为气态,E和F是同分异构体,将等质量的D和E分别完全燃烧消耗氧气的量、生成二氧化碳和水的量两者都相同.请回答下列问题:
(1)写出D和H的结构简式:D
(2)G与过量金属钠反应的化学方程式为
(3)F的银镜反应为
(4)C可用作燃料电池的燃料,在碱性溶液中此电池负极的电极反应为
(5)A与水蒸气在一定条件下反应生成合成气CO和H2,其热化学方程式为(注明催化剂)
ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为 (用元素符号表示)。
(2)As原子核外M层电子的排布式为 。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N互为等电子体的分子的化学式 (任写一种即可)。

图1
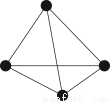
(4)白磷(P4)的结构如图1所示,P原子的轨道杂化方式是 。
(5) 可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
① 的立体构型是 。
的立体构型是 。
②在K3[Co(NO2)6]中,中心离子的配位数为 。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体? (填“是”或“否”)。

图2
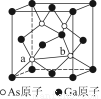
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图2所示,其晶胞边长为cpm,则密度为 g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为 pm(用含c的式子表示)。
(1)N、P、As原子的第一电离能由大到小的顺序为 (用元素符号表示)。
(2)As原子核外M层电子的排布式为 。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N互为等电子体的分子的化学式 (任写一种即可)。

图1
(4)白磷(P4)的结构如图1所示,P原子的轨道杂化方式是 。
(5)
 可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。①
 的立体构型是 。
的立体构型是 。②在K3[Co(NO2)6]中,中心离子的配位数为 。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体? (填“是”或“否”)。

图2
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图2所示,其晶胞边长为cpm,则密度为 g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为 pm(用含c的式子表示)。
ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(2)As原子核外M层电子的排布式为________________________________________________________________________。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
(4)白磷(P4)的结构如图所示,P原子的轨道杂化方式是________。
(5)NO可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
①NO的立体构型是________。
②在K3[Co(NO2)6]中,中心离子的配位数为________。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)。
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为________g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。
查看习题详情和答案>>
ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(2)As原子核外M层电子的排布式为________________________________________________________________________。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
(4)白磷(P4)的结构如图所示,P原子的轨道杂化方式是________。

(5)NO可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
①NO的立体构型是________。
②在K3[Co(NO2)6]中,中心离子的配位数为________。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)。
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为________g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。

(1)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(2)As原子核外M层电子的排布式为________________________________________________________________________。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
(4)白磷(P4)的结构如图所示,P原子的轨道杂化方式是________。

(5)NO可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
①NO的立体构型是________。
②在K3[Co(NO2)6]中,中心离子的配位数为________。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)。
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为________g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。

(2013?海淀区二模)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示.A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液.
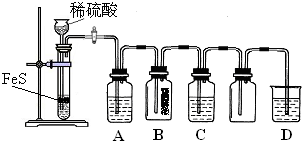
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
②B中的现象是
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
④D中盛放的试剂可以是
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
已知:电离平衡常数:H2S Ka1=1.3×10-7;Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
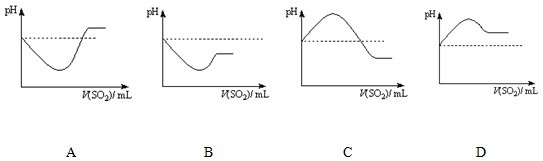
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
查看习题详情和答案>>
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |

回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
H2S+CuSO4=CuS↓+H2SO4
H2S+CuSO4=CuS↓+H2SO4
.②B中的现象是
蓝色石蕊试纸变红
蓝色石蕊试纸变红
.③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
H2S+2Fe3+=S↓+2H++2Fe2+
H2S+2Fe3+=S↓+2H++2Fe2+
.④D中盛放的试剂可以是
d
d
(填标号).a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
酸性(或酸性较强)
酸性(或酸性较强)
条件下,+4价硫的化合物可以氧化-2价硫的化合物.②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
C
C
(填序号).
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
.