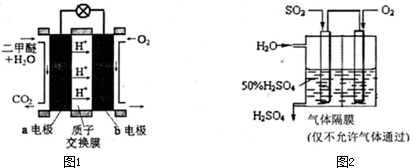
题目内容
CO和H2是合成多种有机化合物的重要原料,亦称作合成气.CO和H2反应在不同条件下得到不同的产物:
现有可以由CO和H2在不同条件下合成的A、C、G三种有机化合物,这三种化合物在上表中都已列出.它们及相关的其他物质有如下的转化关系:

已知:常温常压下,A、B、D均为气态,E和F是同分异构体,将等质量的D和E分别完全燃烧消耗氧气的量、生成二氧化碳和水的量两者都相同.请回答下列问题:
(1)写出D和H的结构简式:D ,H ;写出由B生成C的反应类型 .
(2)G与过量金属钠反应的化学方程式为 .
(3)F的银镜反应为 .
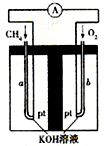
(4)C可用作燃料电池的燃料,在碱性溶液中此电池负极的电极反应为 .
(5)A与水蒸气在一定条件下反应生成合成气CO和H2,其热化学方程式为(注明催化剂) ,为了有利于合成气的生成,压强不采用高压而采用常压的原因是 ,温度应高于 .
| 反应条件 | 主要产物 | 生成1mol有机物 △H/kJ?mol-1 |
| Cu-ZnO-Cr2O3-MnO,200~400℃,30~40MPa | 甲醇 | -128 |
| Ni,250~500℃,常压 | 甲烷(和水蒸气) | -206.2 |
| FeO-Co-Ni,150~350℃,0.1~3MPa | 人造石油 | |
| Ru,150~250℃,10~100MPa | 固态烷烃 | |
| ThO-ZnO-Al2O3,400~500℃,10~100MPa | 异丁烷、异戊烷 | |
| Co-Fe,100~200℃,10~20MPa | 含氧有机化合物 | |
| Rh原子簇配合物,高压液相 | 乙二醇 (少量乙酸、乙醇) |

已知:常温常压下,A、B、D均为气态,E和F是同分异构体,将等质量的D和E分别完全燃烧消耗氧气的量、生成二氧化碳和水的量两者都相同.请回答下列问题:
(1)写出D和H的结构简式:D
(2)G与过量金属钠反应的化学方程式为
(3)F的银镜反应为
(4)C可用作燃料电池的燃料,在碱性溶液中此电池负极的电极反应为
(5)A与水蒸气在一定条件下反应生成合成气CO和H2,其热化学方程式为(注明催化剂)
分析:由A在光照条件下与氯气反应,考虑为烃的卤代反应,由转化故选A→B→C
D,A为烃,B为卤代烃,C为醇,D为醛,常温常压下,A、B、D均为气态,故D为HCHO,C为CH3OH,B为CH3Cl,A为CH4;将等质量的D和E分别完全燃烧消耗氧气的量、生成二氧化碳和水的量两者都相同,故D、E的最简式相同为CH2O,由CH3OH+CO→E,故E为CH3COOH,E和F是同分异构体,且F能催化加氢生成G,F为HOCH2CHO,G为HOCH2CH2OH,E与G反应生成H(C6H10O4),H中无支链,有2中氢原子,该反应为2分子乙酸与1分子乙二醇发生酯化反应,H为CH3COOCH2CH2OOCCH3.
| 催化氧化 |
解答:解:由A在光照条件下与氯气反应,考虑为烃的卤代反应,由转化故选A→B→C
D,A为烃,B为卤代烃,C为醇,D为醛,常温常压下,A、B、D均为气态,故D为HCHO,C为CH3OH,B为CH3Cl,A为CH4;将等质量的D和E分别完全燃烧消耗氧气的量、生成二氧化碳和水的量两者都相同,故D、E的最简式相同为CH2O,由CH3OH+CO→E,故E为CH3COOH,E和F是同分异构体,且F能催化加氢生成G,F为HOCH2CHO,G为HOCH2CH2OH,E与G反应生成H(C6H10O4),H中无支链,有2中氢原子,该反应为2分子乙酸与1分子乙二醇发生酯化反应,H为CH3COOCH2CH2OOCCH3,
(1)由上述分析可知,D为HCHO,H为CH3COOCH2CH2OOCCH3;
B生成C的反应为一氯甲烷在氢氧化钠水溶液、加热的条件下发生的甲醇,属于取代反应;
故答案为:HCHO,CH3COOCH2CH2OOCCH3;取代反应;
(2)G为HOCH2CH2OH,与过量金属钠反应的化学方程式为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑,
故答案为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑;
(3)F为HOCH2CHO,F的银镜反应为:HOCH2CHO+2[Ag(NH3)2]OH
HOCH2COONH4+2Ag↓+3NH3+H2O,
故答案为:HOCH2CHO+2[Ag(NH3)2]OH
HOCH2COONH4+2Ag↓+3NH3+H2O;
(4)原电池负极发生氧化反应,碱性条件下CH3OH在负极放电,发生氧化反应,生成碳酸根与水,负极电极反应式为:CH3OH+8OH--6e-=6H2O+CO32-,
故答案为:CH3OH+8OH--6e-=6H2O+CO32-;
(5)根据表中合成气生成1molCH4的反应热可知,1mol甲烷与水蒸气在一定条件下反应生成合成气CO和H2的△H=+206.2 kJ/mol,故热化学方程式为:CH4(g)+H2O(g)
CO(g)+3H2(g)△H═+206.2 kJ/mol;
此反应是气体总物质的量增大的可逆反应,根据平衡移动原理,常压有利于(高压不利于)合成气的生成,此反应是吸热的可逆反应,根据表中由合成气生成CH4的温度可知:反应温度高于500℃有利于合成气的生成;
故答案为:CH4(g)+H2O(g)
CO(g)+3H2(g)△H═+206.2 kJ/mol,此反应是气体总物质的量增大的可逆反应,根据平衡移动原理,常压有利于合成气的生成;500℃.
| 催化氧化 |
(1)由上述分析可知,D为HCHO,H为CH3COOCH2CH2OOCCH3;
B生成C的反应为一氯甲烷在氢氧化钠水溶液、加热的条件下发生的甲醇,属于取代反应;
故答案为:HCHO,CH3COOCH2CH2OOCCH3;取代反应;
(2)G为HOCH2CH2OH,与过量金属钠反应的化学方程式为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑,
故答案为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑;
(3)F为HOCH2CHO,F的银镜反应为:HOCH2CHO+2[Ag(NH3)2]OH
| 水浴加热 |
故答案为:HOCH2CHO+2[Ag(NH3)2]OH
| 水浴加热 |
(4)原电池负极发生氧化反应,碱性条件下CH3OH在负极放电,发生氧化反应,生成碳酸根与水,负极电极反应式为:CH3OH+8OH--6e-=6H2O+CO32-,
故答案为:CH3OH+8OH--6e-=6H2O+CO32-;
(5)根据表中合成气生成1molCH4的反应热可知,1mol甲烷与水蒸气在一定条件下反应生成合成气CO和H2的△H=+206.2 kJ/mol,故热化学方程式为:CH4(g)+H2O(g)
| Ni |
| △ |
此反应是气体总物质的量增大的可逆反应,根据平衡移动原理,常压有利于(高压不利于)合成气的生成,此反应是吸热的可逆反应,根据表中由合成气生成CH4的温度可知:反应温度高于500℃有利于合成气的生成;
故答案为:CH4(g)+H2O(g)
| Ni |
| △ |
点评:本题考查有机推断与性质、原电池、热化学方程式、平衡移动原理等,难度中等,(4)中电极反应式书写为易错点,可以先写出正极电极反应式,利用总反应式减去正极电极反应式可得负极电极反应式,注意碱性条件下甲醇燃烧生成碳酸钠与水.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
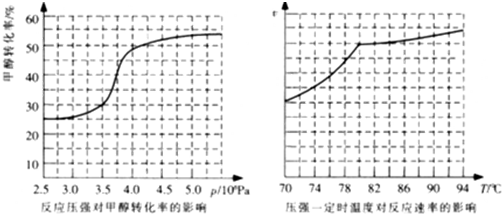
 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
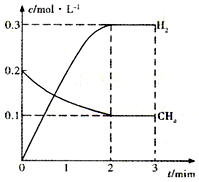
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.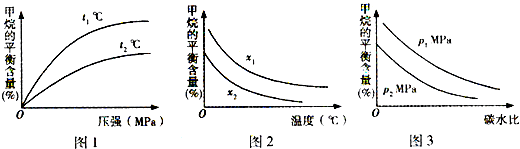
 煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.