摘要:90.0.1ml·L-1H224 40ml恰好将4×10-3ml的V2-还原.则在还原产物V2n-中n 的值为 ( ) A. B.4 .3 D.2
网址:http://m.1010jiajiao.com/timu3_id_73159[举报]
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol?L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入指示剂,进行滴定.滴定至终点,记录数据.
④重复以上过程2次.试回答下列问题:
(1)应将NaOH溶液注入图1?中的
乙
乙
(选填“甲”或“乙”)中.(2)该小组在步骤①中的错误是
没有用待测NaOH溶液润洗碱式滴定管
没有用待测NaOH溶液润洗碱式滴定管
,由此造成的测定结果偏低
偏低
(偏高、偏低或无影响).(3)如图2是某次滴定时的滴定管中的液面,图2表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为
25.40
25.40
mL.(4)该滴定操作中③应选用的指示剂是
酚酞(或甲基橙)
酚酞(或甲基橙)
,滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视?锥形瓶中溶液颜色的变化
锥形瓶中溶液颜色的变化
,如何确定终点?酚酞为指示剂时浅红色变为无色且半分钟不复原(或甲基橙为指示剂时黄色变色橙色且半分钟不复原)
酚酞为指示剂时浅红色变为无色且半分钟不复原(或甲基橙为指示剂时黄色变色橙色且半分钟不复原)
.(5)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.52 | 25.42 |
| 第二次 | 20.00 | 4.07 | 29.17 |
0.1250mol/L
0.1250mol/L
.(6)如有1mol/L和0.1mol/L的HCl溶液,应用
0.1mol/L
0.1mol/L
的HCl溶液,原因是如果用1mol/L盐酸滴定,所消耗体积约为2.50mL,则相对误差较大
如果用1mol/L盐酸滴定,所消耗体积约为2.50mL,则相对误差较大
.对于0.5mol/L Fe2(SO4)3和0.5mol/L CuSO4的混合溶液100mL,可用下列两种方法进行分离、提纯和转化.
方法1、用下图所示的流程进行分离,同时获得硫酸亚铁晶体和铜粉.
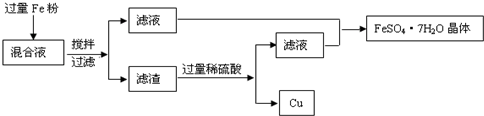
请回答:
(1)由滤液制取FeSO4?7H2O晶体要经过
(2)用100mL的混合液制取FeSO4?7H2O晶体,制得的晶体质量至少
方法2、用纸层析方法进行分离,实验步骤如下:
①点样:如右图所示,在滤纸条末端约2cm处用铅笔画一个小圆点作为原点.
在原点处滴一滴Fe2(SO4)3和CuSO4的混合溶液.晾干后再滴,重复3次,要求留下斑点的直径小于0.5cm.将滤纸条用大头针固定在橡胶塞下面.
②展开:在大试管中加入9mL丙酮和1mL 3mol?L-1硫酸,混合均匀.把滤纸末端浸入溶剂中约0.5cm,注意不要让试样点接触展开剂.塞紧橡胶塞,将大试管垂直静置.
③显色:待溶剂扩散到滤纸上端时,取下滤纸,放在盛有浓氨水的试剂瓶瓶口上方,用氨气熏.请回答:
(3)硫酸的作用是
(4)氨熏后红棕色出现在滤纸上端,其原因是
查看习题详情和答案>>
方法1、用下图所示的流程进行分离,同时获得硫酸亚铁晶体和铜粉.

请回答:
(1)由滤液制取FeSO4?7H2O晶体要经过
加热蒸发
加热蒸发
、冷却结晶
冷却结晶
、过滤、洗涤等步骤,要想加快过滤的速度可以通过抽滤的方法,则抽滤要用到的主要仪器是布氏漏斗、吸滤瓶
布氏漏斗、吸滤瓶
.(2)用100mL的混合液制取FeSO4?7H2O晶体,制得的晶体质量至少
55.6
55.6
g.方法2、用纸层析方法进行分离,实验步骤如下:

①点样:如右图所示,在滤纸条末端约2cm处用铅笔画一个小圆点作为原点.
在原点处滴一滴Fe2(SO4)3和CuSO4的混合溶液.晾干后再滴,重复3次,要求留下斑点的直径小于0.5cm.将滤纸条用大头针固定在橡胶塞下面.
②展开:在大试管中加入9mL丙酮和1mL 3mol?L-1硫酸,混合均匀.把滤纸末端浸入溶剂中约0.5cm,注意不要让试样点接触展开剂.塞紧橡胶塞,将大试管垂直静置.
③显色:待溶剂扩散到滤纸上端时,取下滤纸,放在盛有浓氨水的试剂瓶瓶口上方,用氨气熏.请回答:
(3)硫酸的作用是
抑制Cu2+和Fe3+的水解
抑制Cu2+和Fe3+的水解
;在层析操作时,不让滤纸上的试样点接触展开剂的原因是如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败
如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败
.(4)氨熏后红棕色出现在滤纸上端,其原因是
Fe3+更易溶于丙酮,展开的速度快
Fe3+更易溶于丙酮,展开的速度快
,由色斑的形成和距离
色斑的形成和距离
可判断分离的效果.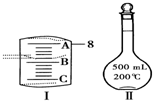 实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:
实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:(1)应该用托盘天平称取Na2CO3?10H2O
14.3
14.3
g.(2)如图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中液体的体积是
7.2
7.2
mL.(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.定容前容量瓶底部有水珠
无影响
无影响
;B.定容时加水超过刻度线
偏低
偏低
;C.最终定容时俯视观察液面
偏高
偏高
.某学生用0.20mol/L KOH溶液滴定未知浓度的盐酸溶液(指示剂为酚酞).请回答下列问题:
(1)如图1表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为
(2)排去碱式滴定管中气泡的方式应采用操作(如图2所示)中的
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取待测液体积均为20.00mL,三次实验结果记录如下:
根据上述数据可以计算出盐酸的物质的量浓度为
(4)实验过程中,下列操作将造成待测盐酸溶液浓度偏高的是
A.实验结束时,俯视刻度线读取滴定终点时KOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.量取待测液的滴定管没有用待测液润洗;
D.锥形瓶水洗后又用待测液润洗;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定.
查看习题详情和答案>>

(1)如图1表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为
25.40
25.40
mL;反应达滴定终点时的现象为锥形瓶中溶液的颜色由无色变浅红,且在半分钟内不褪色
锥形瓶中溶液的颜色由无色变浅红,且在半分钟内不褪色
.(2)排去碱式滴定管中气泡的方式应采用操作(如图2所示)中的
丙
丙
,然后轻轻挤压玻璃球使尖嘴部分充满碱液.(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取待测液体积均为20.00mL,三次实验结果记录如下:
| 滴定次数 | 待测液体积 | 标准KOH溶液体积/ml | 滴定前读数/ml | 滴定后读数/ml | 第一次 | 20.00 | 0.02 | 25.00 | 第二次 | 20.00 | 0.01 | 25.03 | 第三次 | 20.00 | 0.03 | 26.35 |
0.25 mol/L
0.25 mol/L
.(保留两位有效数字)(4)实验过程中,下列操作将造成待测盐酸溶液浓度偏高的是
B D
B D
.A.实验结束时,俯视刻度线读取滴定终点时KOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.量取待测液的滴定管没有用待测液润洗;
D.锥形瓶水洗后又用待测液润洗;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定.