题目内容
对于0.5mol/L Fe2(SO4)3和0.5mol/L CuSO4的混合溶液100mL,可用下列两种方法进行分离、提纯和转化.
方法1、用下图所示的流程进行分离,同时获得硫酸亚铁晶体和铜粉.
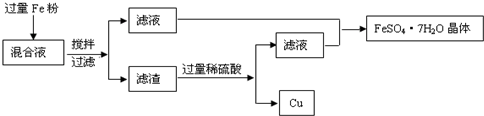
请回答:
(1)由滤液制取FeSO4?7H2O晶体要经过
(2)用100mL的混合液制取FeSO4?7H2O晶体,制得的晶体质量至少
方法2、用纸层析方法进行分离,实验步骤如下:
①点样:如右图所示,在滤纸条末端约2cm处用铅笔画一个小圆点作为原点.
在原点处滴一滴Fe2(SO4)3和CuSO4的混合溶液.晾干后再滴,重复3次,要求留下斑点的直径小于0.5cm.将滤纸条用大头针固定在橡胶塞下面.
②展开:在大试管中加入9mL丙酮和1mL 3mol?L-1硫酸,混合均匀.把滤纸末端浸入溶剂中约0.5cm,注意不要让试样点接触展开剂.塞紧橡胶塞,将大试管垂直静置.
③显色:待溶剂扩散到滤纸上端时,取下滤纸,放在盛有浓氨水的试剂瓶瓶口上方,用氨气熏.请回答:
(3)硫酸的作用是
(4)氨熏后红棕色出现在滤纸上端,其原因是
方法1、用下图所示的流程进行分离,同时获得硫酸亚铁晶体和铜粉.

请回答:
(1)由滤液制取FeSO4?7H2O晶体要经过
加热蒸发
加热蒸发
、冷却结晶
冷却结晶
、过滤、洗涤等步骤,要想加快过滤的速度可以通过抽滤的方法,则抽滤要用到的主要仪器是布氏漏斗、吸滤瓶
布氏漏斗、吸滤瓶
.(2)用100mL的混合液制取FeSO4?7H2O晶体,制得的晶体质量至少
55.6
55.6
g.方法2、用纸层析方法进行分离,实验步骤如下:

①点样:如右图所示,在滤纸条末端约2cm处用铅笔画一个小圆点作为原点.
在原点处滴一滴Fe2(SO4)3和CuSO4的混合溶液.晾干后再滴,重复3次,要求留下斑点的直径小于0.5cm.将滤纸条用大头针固定在橡胶塞下面.
②展开:在大试管中加入9mL丙酮和1mL 3mol?L-1硫酸,混合均匀.把滤纸末端浸入溶剂中约0.5cm,注意不要让试样点接触展开剂.塞紧橡胶塞,将大试管垂直静置.
③显色:待溶剂扩散到滤纸上端时,取下滤纸,放在盛有浓氨水的试剂瓶瓶口上方,用氨气熏.请回答:
(3)硫酸的作用是
抑制Cu2+和Fe3+的水解
抑制Cu2+和Fe3+的水解
;在层析操作时,不让滤纸上的试样点接触展开剂的原因是如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败
如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败
.(4)氨熏后红棕色出现在滤纸上端,其原因是
Fe3+更易溶于丙酮,展开的速度快
Fe3+更易溶于丙酮,展开的速度快
,由色斑的形成和距离
色斑的形成和距离
可判断分离的效果.分析:(1)根据溶液来得到晶体来分析实验操作;依据抽滤装置的组成和原理分析判断仪器;
(2)0.5mol/L Fe2(SO4)3和0.5mol/L CuSO4的混合溶液100mL,与过量铁作用硫酸根最终都变成硫酸亚铁,根据硫酸根守恒解答;
(3)Cu2+和Fe3+的水解溶液呈酸性,加硫酸可抑制Cu2+和Fe3+的水解;纸上层析法依据极性相似相溶原理,是以滤纸纤维的结合水为固定相,而以有机溶剂作为流动相,由于样品中各物质分配系数不同,因而扩散速度不同,从而达到分离的目的,据此分析解答;
(4)该题的展开剂为9mL丙酮和1mL 3mol?L-1硫酸,根据Fe3+在丙酮中的溶解能力进行解答;纸上层析法由于样品中各物质分配系数不同,因而扩散速度不同而形成不同位置的色斑.
(2)0.5mol/L Fe2(SO4)3和0.5mol/L CuSO4的混合溶液100mL,与过量铁作用硫酸根最终都变成硫酸亚铁,根据硫酸根守恒解答;
(3)Cu2+和Fe3+的水解溶液呈酸性,加硫酸可抑制Cu2+和Fe3+的水解;纸上层析法依据极性相似相溶原理,是以滤纸纤维的结合水为固定相,而以有机溶剂作为流动相,由于样品中各物质分配系数不同,因而扩散速度不同,从而达到分离的目的,据此分析解答;
(4)该题的展开剂为9mL丙酮和1mL 3mol?L-1硫酸,根据Fe3+在丙酮中的溶解能力进行解答;纸上层析法由于样品中各物质分配系数不同,因而扩散速度不同而形成不同位置的色斑.
解答:解:(1)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,将析出的固体洗涤、干燥,即可得到绿矾,抽滤装置不同于普通过滤装置,由减压系统(真空泵),吸滤瓶和布氏漏斗等组成,
故答案为:加热蒸发;冷却结晶;布氏漏斗、吸滤瓶;
(2)因为Fe+Fe2(SO4)3=3FeSO4,Fe+CuSO4═Cu+FeSO4;,所以加过量铁后,溶液中溶质是硫酸亚铁,硫酸根最终都变成硫酸亚铁,根据硫酸根守恒,0.5mol/L Fe2(SO4)3和0.5mol/L CuSO4的混合溶液100mL,n(FeSO4)=n(SO42-)=0.1L×0.5mol/L×3+0.1L×0.5mol/L=0.2mol,n(FeSO4?7H2O)=n(FeSO4)=0.2mol,所以m(FeSO4?7H2O)=0.2mol×278g/mol=55.6g,
故答案为:55.6;
(3)Fe3+发生水解反应:Fe3++3H2O?Fe(OH)3+3H+,Cu2+发生水解反应:Cu2++2H2O?Cu(OH)2+2H+,加入硫酸,可抑制Cu2+和Fe3+的水解;纸上层析中要求流动相溶剂对分离物质应有适当的溶解度,由于样品中各物质分配系数不同,因而扩散速度不同,所以纸上层析法是利用试样中各种离子随展开剂在滤纸上展开的速率不同而形成不同位置的色斑,如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败,
故答案为:抑制Cu2+和Fe3+的水解;如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败;
(4)该题的展开剂为9mL丙酮和1mL 3mol?L-1硫酸,Fe3+更易溶于丙酮,展开的速度快,所以因氨熏后红棕色出现在滤纸上端;纸上层析法由于样品中各物质分配系数不同,因而扩散速度不同而形成不同位置的色斑,所以色斑的形成和距离可判断分离的效果,
故答案为:Fe3+更易溶于丙酮,展开的速度快;色斑的形成和距离.
故答案为:加热蒸发;冷却结晶;布氏漏斗、吸滤瓶;
(2)因为Fe+Fe2(SO4)3=3FeSO4,Fe+CuSO4═Cu+FeSO4;,所以加过量铁后,溶液中溶质是硫酸亚铁,硫酸根最终都变成硫酸亚铁,根据硫酸根守恒,0.5mol/L Fe2(SO4)3和0.5mol/L CuSO4的混合溶液100mL,n(FeSO4)=n(SO42-)=0.1L×0.5mol/L×3+0.1L×0.5mol/L=0.2mol,n(FeSO4?7H2O)=n(FeSO4)=0.2mol,所以m(FeSO4?7H2O)=0.2mol×278g/mol=55.6g,
故答案为:55.6;
(3)Fe3+发生水解反应:Fe3++3H2O?Fe(OH)3+3H+,Cu2+发生水解反应:Cu2++2H2O?Cu(OH)2+2H+,加入硫酸,可抑制Cu2+和Fe3+的水解;纸上层析中要求流动相溶剂对分离物质应有适当的溶解度,由于样品中各物质分配系数不同,因而扩散速度不同,所以纸上层析法是利用试样中各种离子随展开剂在滤纸上展开的速率不同而形成不同位置的色斑,如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败,
故答案为:抑制Cu2+和Fe3+的水解;如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败;
(4)该题的展开剂为9mL丙酮和1mL 3mol?L-1硫酸,Fe3+更易溶于丙酮,展开的速度快,所以因氨熏后红棕色出现在滤纸上端;纸上层析法由于样品中各物质分配系数不同,因而扩散速度不同而形成不同位置的色斑,所以色斑的形成和距离可判断分离的效果,
故答案为:Fe3+更易溶于丙酮,展开的速度快;色斑的形成和距离.
点评:本题主要考查了FeSO4?7H2O晶体的制备、纸层析方法等知识,掌握盐类水解的影响因素,掌握纸层析方法的原理是解答的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.