摘要: 有如下两个反应:(1)+2Ag+→2++2Ag,Fe+2+→Fe2++.根据上述反应.判断Ag+.2+.Fe2+氧化性强弱顺序排列正确的是() A.Ag+>2+>Fe2+ B.2+>Ag+>Fe2+ .Ag+>Fe2+>2+ D.Fe2+>2+>Ag+ 贵州省贵阳一中2011届高三化学一轮复习专题题库:
网址:http://m.1010jiajiao.com/timu3_id_72962[举报]
有如下两个反应:①2HCl
H2+Cl2 ②2HCl
H2↑+Cl2关于这两个反应的叙述中错误的是( )
| ||
| ||
| A、①②两反应都是氧化还原反应 |
| B、①②两反应中的能量转换方式都是热能转变为化学能 |
| C、②反应是电能转变为化学能 |
| D、①反应是热能转变为化学能 |
有如下两个反应:A、2HCl+Ba(OH)2═BaCl2+2H2O B、2Fe3++Cu═2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是
②写出负极的电极反应式
③若导线上转移电子0.2mol,则负极质量变化是
查看习题详情和答案>>
(1)根据两反应的本质,判断能否设计成原电池:A
不能
不能
B能
能
(填“能”或“不能”)不能设计成原电池的原因是有电子得失或电子对转移的反应才能设计成原电池
有电子得失或电子对转移的反应才能设计成原电池
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是
铜
铜
,正极材料是石墨
石墨
,电解质溶液是氯化铁溶液
氯化铁溶液
②写出负极的电极反应式
Cu-2e-=Cu2+
Cu-2e-=Cu2+
③若导线上转移电子0.2mol,则负极质量变化是
减少6.4g
减少6.4g
.(2010?湘潭三模)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图甲装置进行有关实验,请回答:
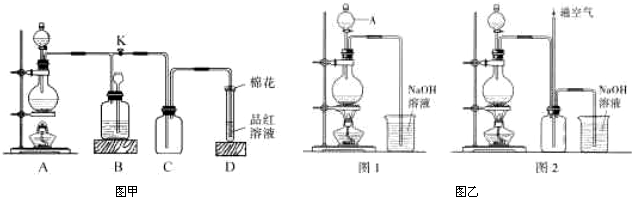
(1)装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是
(2)装置B的作用是贮存多余的气体,B中应放置的液体是(填字母)
a.NaOH溶液 b.酸性KmnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
(3)铜不能与稀硫酸直接反应得到硫酸铜,但可用下面方法制取:将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发浓缩、冷却结晶可制得硫酸铜晶体(装置如图乙图1、2所示).
①将硝酸分多次加入到铜粉与稀硫酸的混合物中,写出该反应的离子方程式
②已知NO不能被NaOH溶液直接吸收,但已知有如下两个反应:
NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO3+NaNO2+H2O.图2是图1的改进装置,其优点除可以防止倒吸外还有:
(3)如果用1molCu来制取1molCuSO4,则所需12mol/L的硝酸体积为
查看习题详情和答案>>

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是
防止SO2扩散而造成污染气体
防止SO2扩散而造成污染气体
.(2)装置B的作用是贮存多余的气体,B中应放置的液体是(填字母)
d
d
.a.NaOH溶液 b.酸性KmnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
长颈漏斗导管中液柱升高
长颈漏斗导管中液柱升高
.(3)铜不能与稀硫酸直接反应得到硫酸铜,但可用下面方法制取:将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发浓缩、冷却结晶可制得硫酸铜晶体(装置如图乙图1、2所示).
①将硝酸分多次加入到铜粉与稀硫酸的混合物中,写出该反应的离子方程式
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.②已知NO不能被NaOH溶液直接吸收,但已知有如下两个反应:
NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO3+NaNO2+H2O.图2是图1的改进装置,其优点除可以防止倒吸外还有:
促进氮的氧化物被充分吸收
促进氮的氧化物被充分吸收
.(3)如果用1molCu来制取1molCuSO4,则所需12mol/L的硝酸体积为
55.6
55.6
mL,(假设HNO3的还原产物全为NO),若所得尾气恰好被NaOH溶液完全吸收,需通入空气的体积为18.7L
18.7L
.(假设实验体积为标准状况下测定,并忽略装置中原有空气的影响,以上数据均保留小数点后一位.) M(g)+N(g)②A(g)
M(g)+N(g)②A(g) C(g)+B(g),起始时c(E)>c(A),且①的反应温度高于②(其他条件不变),则两反应的速率大小为( )
C(g)+B(g),起始时c(E)>c(A),且①的反应温度高于②(其他条件不变),则两反应的速率大小为( )