题目内容
(2010?湘潭三模)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图甲装置进行有关实验,请回答:
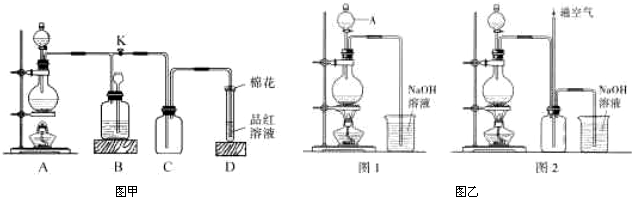
(1)装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是
(2)装置B的作用是贮存多余的气体,B中应放置的液体是(填字母)
a.NaOH溶液 b.酸性KmnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
(3)铜不能与稀硫酸直接反应得到硫酸铜,但可用下面方法制取:将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发浓缩、冷却结晶可制得硫酸铜晶体(装置如图乙图1、2所示).
①将硝酸分多次加入到铜粉与稀硫酸的混合物中,写出该反应的离子方程式
②已知NO不能被NaOH溶液直接吸收,但已知有如下两个反应:
NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO3+NaNO2+H2O.图2是图1的改进装置,其优点除可以防止倒吸外还有:
(3)如果用1molCu来制取1molCuSO4,则所需12mol/L的硝酸体积为

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是
防止SO2扩散而造成污染气体
防止SO2扩散而造成污染气体
.(2)装置B的作用是贮存多余的气体,B中应放置的液体是(填字母)
d
d
.a.NaOH溶液 b.酸性KmnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
长颈漏斗导管中液柱升高
长颈漏斗导管中液柱升高
.(3)铜不能与稀硫酸直接反应得到硫酸铜,但可用下面方法制取:将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发浓缩、冷却结晶可制得硫酸铜晶体(装置如图乙图1、2所示).
①将硝酸分多次加入到铜粉与稀硫酸的混合物中,写出该反应的离子方程式
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.②已知NO不能被NaOH溶液直接吸收,但已知有如下两个反应:
NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO3+NaNO2+H2O.图2是图1的改进装置,其优点除可以防止倒吸外还有:
促进氮的氧化物被充分吸收
促进氮的氧化物被充分吸收
.(3)如果用1molCu来制取1molCuSO4,则所需12mol/L的硝酸体积为
55.6
55.6
mL,(假设HNO3的还原产物全为NO),若所得尾气恰好被NaOH溶液完全吸收,需通入空气的体积为18.7L
18.7L
.(假设实验体积为标准状况下测定,并忽略装置中原有空气的影响,以上数据均保留小数点后一位.)分析:(1)依据二氧化硫是污染性气体,不能排放到大气中分析;
(2)依据储气装置的原理是利用压强大小,密闭容器通过改变液面的高低调节分析,试剂不能和气体反应也不能溶于液体;
(3)①根据铜粉和足量稀硫酸不反应而与稀硝酸可以反应;
②根据NOX易与氢氧化钠溶液反应分析;
(3)HNO3的还原产物全为NO,依据3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,计算需要的硝酸溶液体积;依据一氧化氮和氧气反应生成二氧化氮被氢氧化钠溶液全部吸收的反应定量关系,最小需要氧气的体积计算得到;
(2)依据储气装置的原理是利用压强大小,密闭容器通过改变液面的高低调节分析,试剂不能和气体反应也不能溶于液体;
(3)①根据铜粉和足量稀硫酸不反应而与稀硝酸可以反应;
②根据NOX易与氢氧化钠溶液反应分析;
(3)HNO3的还原产物全为NO,依据3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,计算需要的硝酸溶液体积;依据一氧化氮和氧气反应生成二氧化氮被氢氧化钠溶液全部吸收的反应定量关系,最小需要氧气的体积计算得到;
解答:解:(1)二氧化硫气体排放到大气中污染环境,所以装置D中试管口放置的棉花中应浸一种液体能与二氧化硫反应,可以浸氢氧化钠溶液或碳酸钠溶液等碱性溶液,作用是吸收多余的二氧化硫气体,防止污染空气,故答案为:氢氧化钠溶液或碳酸钠溶液等碱性溶液;吸收多余的二氧化硫,防止污染空气;
故答案为:防止SO2扩散而造成污染体;
(2)置B的作用是贮存多余的气体,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,在密闭容器中随着气体的生成,广口瓶内压强增大,会使瓶内液面下降,长颈漏斗中液面上升,最终达到内外大气压相同,二氧化硫气体是酸性氧化物,易溶于水,B中的试剂不能和二氧化硫发生反应,不能溶解二氧化硫,
a.水能溶解二氧化硫不能储存气体,故a错误;
b.酸性KMnO4 溶液能氧化二氧化硫为硫酸,不能储存气体,故b错误;
c.NaOH溶液吸收二氧化硫不能储存气体,故c错误;
d.二氧化硫通入饱和NaHSO3溶液中,降低了二氧化硫的溶解度,不反应,可以用来储存气体,故d正确;
故答案为:d,长颈漏斗导管中液柱升高;
(3)①加入硝酸的目的因为稀硫酸不与铜反应,而硝酸可以把铜氧化成铜离子,生成硫酸铜,浓硝酸分多次目的转移电子数更多即生成一氧化氮,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②因二氧化氮易与氢氧化钠溶液反应,要防止倒吸,
故答案为:使NOX充分被吸收.
(3)HNO3的还原产物全为NO,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;则用1molCu来制取1molCuSO4,需要的硝酸物质的量为
mol,则所需12mol/L的硝酸体积=
=0.0556L=55.6ml;
HNO3的还原产物全为NO,依据上述计算得到一氧化氮气体物质的量为
mol,一氧化氮和氧气反应生成二氧化氮全部被氢氧化钠溶液吸收,有以下几种吸收情况:
①NO+NO2+2NaOH=2NaNO2+H2O;
②2NO2+2NaOH=NaNO3+NaNO2+H2O,
完全吸收气体一氧化氮,按照①反应,一氧化氮只有
mol被氧化,需要氧气
mol,标准状况下空气的体积=
mol×5×22.4L/mol=18.7L;
故答案为:55.6mL,18.7L;
故答案为:防止SO2扩散而造成污染体;
(2)置B的作用是贮存多余的气体,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,在密闭容器中随着气体的生成,广口瓶内压强增大,会使瓶内液面下降,长颈漏斗中液面上升,最终达到内外大气压相同,二氧化硫气体是酸性氧化物,易溶于水,B中的试剂不能和二氧化硫发生反应,不能溶解二氧化硫,
a.水能溶解二氧化硫不能储存气体,故a错误;
b.酸性KMnO4 溶液能氧化二氧化硫为硫酸,不能储存气体,故b错误;
c.NaOH溶液吸收二氧化硫不能储存气体,故c错误;
d.二氧化硫通入饱和NaHSO3溶液中,降低了二氧化硫的溶解度,不反应,可以用来储存气体,故d正确;
故答案为:d,长颈漏斗导管中液柱升高;
(3)①加入硝酸的目的因为稀硫酸不与铜反应,而硝酸可以把铜氧化成铜离子,生成硫酸铜,浓硝酸分多次目的转移电子数更多即生成一氧化氮,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②因二氧化氮易与氢氧化钠溶液反应,要防止倒吸,
故答案为:使NOX充分被吸收.
(3)HNO3的还原产物全为NO,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;则用1molCu来制取1molCuSO4,需要的硝酸物质的量为
| 2 |
| 3 |
| ||
| 12mol/L |
HNO3的还原产物全为NO,依据上述计算得到一氧化氮气体物质的量为
| 2 |
| 3 |
①NO+NO2+2NaOH=2NaNO2+H2O;
②2NO2+2NaOH=NaNO3+NaNO2+H2O,
完全吸收气体一氧化氮,按照①反应,一氧化氮只有
| 1 |
| 3 |
| 1 |
| 6 |
| 1 |
| 6 |
故答案为:55.6mL,18.7L;
点评:本题考查了浓硫酸的性质应用,反应产物的验证、测定方法的设定和判断,关键是产物中的二氧化硫性质的应用.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
 (2010?湘潭三模)某装置如图所示,下列有关叙述正确的是( )
(2010?湘潭三模)某装置如图所示,下列有关叙述正确的是( ) (2010?湘潭三模)下表所列各物质组中,物质a、b、c之间通过一步反应就能实现如图所示转化的是( )
(2010?湘潭三模)下表所列各物质组中,物质a、b、c之间通过一步反应就能实现如图所示转化的是( )