摘要:已知:①2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ·mol-1 ②H+(aq) + OH-(aq) = H2O(l) △H = -57.3kJ·mol-1. 下列说法中错误的是( ) A.①式表示25℃.101 kPa时.2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ B.2H2(g) + O2(g) = 2H2O(g)中△H大于-571.6 kJ·mol-1 C.将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量为57.3 kJ D.将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ [答案]C.
网址:http://m.1010jiajiao.com/timu3_id_71652[举报]
下列说法正确的是( )
| A、同温同压下,H2 (g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 | B、任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | C、已知:①2H2(g)+O2(g)=2H2O(g)△H=-a kJ?mol-1,②2H2(g)+O2 (g)=2H2O(1)△H=-b kJ?mol-1,则a>b | D、已知:①C(s,石墨)+O2 (g)=CO2(g)△H=-393.5kJ?mol-1,②C(s,金刚石)+O2(g)=CO2 (g)△H=-395.0 kJ?mol-1, 则C(s,石墨)=C(s,金刚石)△H=-1.5 kJ?mol-1 |
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)选择性催化还原法的脱硝原理为:6NOx+4xNH3
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
L.
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
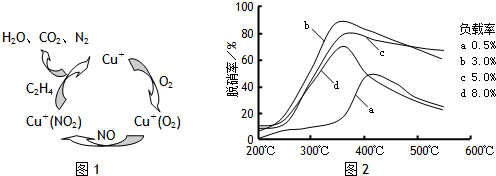
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示.
①写出该脱硝原理总反应的化学方程式:
②为达到最佳脱硝效果,应采取的条件是
查看习题详情和答案>>
(1)选择性催化还原法的脱硝原理为:6NOx+4xNH3
| ||
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
| 16.8+11.2x |
| x |
| 16.8+11.2x |
| x |
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
-724.5kJ?mol-1
-724.5kJ?mol-1
.(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示.

①写出该脱硝原理总反应的化学方程式:
6NO+3O2+2C2H4
3N2+4CO2+4H2O
| ||
6NO+3O2+2C2H4
3N2+4CO2+4H2O
.
| ||
②为达到最佳脱硝效果,应采取的条件是
350℃、负载率3%
350℃、负载率3%
.(1)5.7g汽油(主要成分为C8H18,相对分子质量为114)完全燃烧生成液态水和CO2,放出275.9KJ的热量,则汽油的燃烧热为
(2)已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol;H2O(l)=H2O(g)△H=+44KJ/mol
a)写出H2与O2反应生成液态水时的热化学方程式
b)在通常情况下,若要得到857.4KJ的热量,需H2的质量为
查看习题详情和答案>>
C8H18(l)+
O2(g)→8CO2(g)+9H2O(l)△H=-5518KJ/mol;
| 25 |
| 2 |
C8H18(l)+
O2(g)→8CO2(g)+9H2O(l)△H=-5518KJ/mol;
| 25 |
| 2 |
(2)已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol;H2O(l)=H2O(g)△H=+44KJ/mol
a)写出H2与O2反应生成液态水时的热化学方程式
2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol
2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol
b)在通常情况下,若要得到857.4KJ的热量,需H2的质量为
6g
6g
,这些H2在标况下的体积为67.2L
67.2L
.(2013?乐山二模)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量
(2)容器①中反应达平衡时,CO的转化率为
(3)计算容器②中反应的平衡常数K=
(4)下列叙述正确的是
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=
mol/(L?min)
(5)已知:2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)
查看习题详情和答案>>
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
小于
小于
(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.(2)容器①中反应达平衡时,CO的转化率为
80
80
%.(3)计算容器②中反应的平衡常数K=
1
1
.(4)下列叙述正确的是
a
a
(填字母序号).a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=
| 4 |
| Vt1 |
(5)已知:2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol
.(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)
3CO2+5OH-═2CO32-+HCO3-+2H2O
3CO2+5OH-═2CO32-+HCO3-+2H2O
.