摘要:将三份锌粉分别装入甲乙丙三支试管中,向甲试管加入50mL pH=3的盐酸.向乙试管加入50mLpH=3的醋酸溶液.向丙试管依次加入50mLpH=3的醋酸溶液和少量的无水硫酸铜粉末.反应结束后产生的H2体积在相同条件下一样多且无锌粉剩余.请回答下列问题(用“< .“ > .“ = 表示大小关系) (1)开始反应时.甲乙丙速率大小关系为 (2)反应过程中.丙比乙速率快的原因是 (3)反应结束时甲乙丙所需时间关系为 (4)三支试管中参加反应的锌的质量关系是 [解析](1)反应开始时.三支试管中PH均为3.即[H+]相同.所以反应速率相同. (2)因为丙中有硫酸铜.锌置换出单质铜.形成原电池.加快了锌粉的反应速率 (3)反应开始后.甲中[H+]就会小于乙.而丙中又形成原电池.所以反应速率丙>乙>甲 (4)生成氢气体积相同.丙中锌粉一部分与硫酸铜发生反应.所以丙中锌粉最多.甲乙中锌粉相同 [答案]= v(丙) (2)丙中构成了原电池.速率加快 (3) 甲>乙>丙 (4)甲=乙<丙
网址:http://m.1010jiajiao.com/timu3_id_71593[举报]
将过量的锌粉分别装入A、B两支试管中,加入等浓度、等体积的稀硫酸,同时向装A中加入少量CuSO4溶液.如下图表示产生氢气的体积V与时间t的关系,其中正确的是( )
A、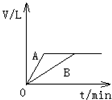 | B、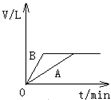 | C、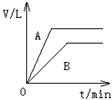 | D、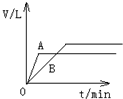 |
称取三份锌粉,分别盛于甲、乙、丙三支试管中.甲加入50mLpH=3的盐酸,乙加入50mLpH=3的醋酸,丙加入50mLpH=3的醋酸及少量的胆矾粉末.若反应终了,生成氢气的体积一样多,且没有剩余的锌,则下列说法错误的是( )
查看习题详情和答案>>
(2012?琼海一模)取三份锌粉,分盛于甲、乙、丙三支试管中,分别加入以下物质后,及时塞上导管塞子,充分反应.甲加入50mLpH=2盐酸,乙加入50mL pH=2醋酸,丙加入50mL pH=2醋酸及少量的胆矾粉末.
(1)若反应终了甲和乙中产生氢气的体积一样多,且只有一支试管中金属有剩余,则开始时加入的锌的质量大小关系为
(2)若反应终了生成氢气的体积一样多,且没有剩余的锌.回答以下问题.
①三支试管中参加反应的锌的质量大小关系为:
②反应终了,所需时间为:
③若以上三组实验,锌粉均过量,产生的氢气体积
查看习题详情和答案>>
(1)若反应终了甲和乙中产生氢气的体积一样多,且只有一支试管中金属有剩余,则开始时加入的锌的质量大小关系为
甲>乙
甲>乙
(以上用“甲、乙”和“>、<、=”回答)(2)若反应终了生成氢气的体积一样多,且没有剩余的锌.回答以下问题.
①三支试管中参加反应的锌的质量大小关系为:
丙>甲=乙
丙>甲=乙
(用“甲、乙、丙”和“>、<、=”回答)②反应终了,所需时间为:
甲>乙>丙
甲>乙>丙
(同①)③若以上三组实验,锌粉均过量,产生的氢气体积
乙=丙>甲
乙=丙>甲
(同①)