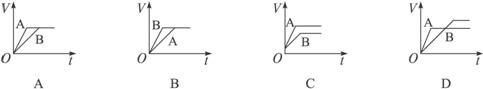题目内容
将过量的锌粉分别装入A、B两支试管中,加入等浓度、等体积的稀硫酸,同时向装A中加入少量CuSO4溶液.如下图表示产生氢气的体积V与时间t的关系,其中正确的是( )
A、 | B、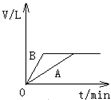 | C、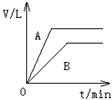 | D、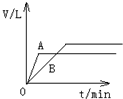 |
分析:在A中加入加入少量CuSO4溶液,锌置换出铜可形成铜锌原电池,由于锌过量,生成的氢气应相等,以此解答该题.
解答:解:在A中加入加入少量CuSO4溶液,锌置换出铜可形成铜锌原电池,反应速率增大,由于锌过量,则硫酸完全反应,生成的氢气应相等,则只有A符合.
故选A.
故选A.
点评:本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意原电池反应的特点以及锌粉过量的信息,难度不大.

练习册系列答案
相关题目