摘要:C 解析:化工专家侯德榜发明了“联合制碱法 .被后人称为“侯氏联合制碱法 .
网址:http://m.1010jiajiao.com/timu3_id_7134[举报]
(2012?扬中市模拟)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O═NH4HCO3;
NH4HCO3+NaCl═NaHCO3↓+NH4Cl;
2NaHCO3
Na2CO3+CO2↑+H2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
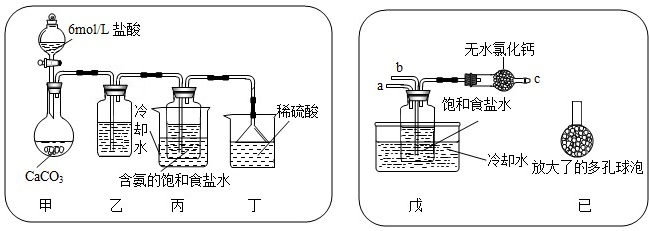
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 饱和的碳酸氢钠溶液,作用是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
(4)“纯碱中常常会混有少量氯化钠.”某研究性学习小组以一包纯碱(只考虑含氯化钠)为研究对象,探究纯碱样品中碳酸钠的含量.
【实验设计】
甲方案
Ⅰ.设计思路:根据样品与氯化钙溶液反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
Ⅱ.操作步骤:称取13.25g纯碱样品,加入过量的氯化钙溶液,充分搅拌.过滤、洗涤、干燥,得到的白色沉淀10.00g.
Ⅲ.数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数.
计算过程:
乙方案
I.设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
II.实验结论:
(1)当a、b的质量关系满足
=
(或22a=53b;或a=
b等)
=
(或22a=53b;或a=
b等)(填写含a、b字母的表达式,下同)时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%.
(2)当a、b的质量关系满足
>
>
时,纯碱样品室有碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是
×100%
×100%.
【实验评价】
误差分析:
(一)甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小.如果将氯化钙溶液换成氯化钡溶液,则可以使误差减小,理由是
(二)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比
查看习题详情和答案>>
NH3+CO2+H2O═NH4HCO3;
NH4HCO3+NaCl═NaHCO3↓+NH4Cl;
2NaHCO3
| ||
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
c
c
(填字母标号).a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 饱和的碳酸氢钠溶液,作用是
吸收甲装置可能挥发出的氯化氢气体
吸收甲装置可能挥发出的氯化氢气体
;(Ⅱ)丁装置中稀硫酸的作用是
吸收末反应的NH3
吸收末反应的NH3
;(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是
过滤
过滤
(填分离操作的名称).②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从
a
a
管通入氨气
氨气
气体;(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
增大气体与溶液接触面积,提高CO2吸收率
增大气体与溶液接触面积,提高CO2吸收率
;(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
用碳酸氢铵与适量饱和食盐水反应.(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等.其他合理方法均可)
用碳酸氢铵与适量饱和食盐水反应.(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等.其他合理方法均可)
.(4)“纯碱中常常会混有少量氯化钠.”某研究性学习小组以一包纯碱(只考虑含氯化钠)为研究对象,探究纯碱样品中碳酸钠的含量.
【实验设计】
甲方案
Ⅰ.设计思路:根据样品与氯化钙溶液反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
Ⅱ.操作步骤:称取13.25g纯碱样品,加入过量的氯化钙溶液,充分搅拌.过滤、洗涤、干燥,得到的白色沉淀10.00g.
Ⅲ.数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数.
计算过程:
解:设纯碱样品中含Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
=
x=10.6g
纯碱样品中Na2CO3的质量分数为
×100%=80%
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
| 106 |
| 100 |
| x |
| 10.00g |
x=10.6g
纯碱样品中Na2CO3的质量分数为
| 10.6g |
| 13.25g |
解:设纯碱样品中含Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
=
x=10.6g
纯碱样品中Na2CO3的质量分数为
×100%=80%
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
| 106 |
| 100 |
| x |
| 10.00g |
x=10.6g
纯碱样品中Na2CO3的质量分数为
| 10.6g |
| 13.25g |
乙方案
I.设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
II.实验结论:
(1)当a、b的质量关系满足
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
(2)当a、b的质量关系满足
| a |
| b |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| 53b |
| 22a |
| 53b |
| 22a |
【实验评价】
误差分析:
(一)甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小.如果将氯化钙溶液换成氯化钡溶液,则可以使误差减小,理由是
BaCl2比CaCl2的相对分子质量大,产生的沉淀质量大,称量误差小
BaCl2比CaCl2的相对分子质量大,产生的沉淀质量大,称量误差小
.(二)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比
偏小
偏小
(填“偏大”、“偏小”、或“不变”).
我国化工专家侯德榜曾为世界制碱工业作出了突出贡献.“侯氏制碱法”是以食盐、氨气、二氧化碳等为原料先制得N.HCq,进而生产出纯碱.其生产过程用化学方程式可简要表示为:
①NH3+H2O+CO2=NH4HCO3;②NH4HCO3+NaCl=NaHCO3↓+NH4Cl;③2NaHCO3
Na2CO3+H2O+CO2↑.
(1)“侯氏制碱法”生产过程中涉及到的基本反应类型是 .
A.置换反应;B.化合反应;C.分解反应;D.复分解反应
(2)第②步中加入的是磨细的食盐粉,食盐磨细的目的是 .
若第②步中得到的NaHCO3中含有少量的NH4HCO3,但不会影响产品Na2CO3的纯度,原因是 .
(3)若纯碱中含有NaHCO3杂质,为测定试样中纯碱的质量分数,用右图中的装置进行实验.主要实验步骤如下: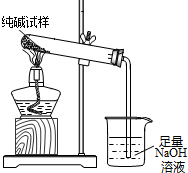
用天平准确称量出干燥试管的质量为20.2克,然后称取4.0克已研碎的纯碱样品并放入干燥的试管中.用酒精灯加热,待充分反应并冷却后,在天平上称出试管和碳酸钠的质量23.5克.
①停止加热前,要进行的操作是 .
②该试样中纯碱的质量分数为 .
查看习题详情和答案>>
①NH3+H2O+CO2=NH4HCO3;②NH4HCO3+NaCl=NaHCO3↓+NH4Cl;③2NaHCO3
| ||
(1)“侯氏制碱法”生产过程中涉及到的基本反应类型是
A.置换反应;B.化合反应;C.分解反应;D.复分解反应
(2)第②步中加入的是磨细的食盐粉,食盐磨细的目的是
若第②步中得到的NaHCO3中含有少量的NH4HCO3,但不会影响产品Na2CO3的纯度,原因是
(3)若纯碱中含有NaHCO3杂质,为测定试样中纯碱的质量分数,用右图中的装置进行实验.主要实验步骤如下:

用天平准确称量出干燥试管的质量为20.2克,然后称取4.0克已研碎的纯碱样品并放入干燥的试管中.用酒精灯加热,待充分反应并冷却后,在天平上称出试管和碳酸钠的质量23.5克.
①停止加热前,要进行的操作是
②该试样中纯碱的质量分数为
我国化工专家侯德榜先生发明的“侯氏制碱法”的基本原理是:在浓氨水中通入足量的二氧化碳生成一种盐,然后在此溶液中加入细小的食盐粉末;由于碳酸氢钠在该状态下溶解度很小,呈晶体析出,同时由于碳酸氢钠不稳定,加热后生成纯碱.水和二氧化碳;再向析出碳酸氢钠后的氯化铵溶液中加入食盐,使其中的氯化铵单独结晶出来,氯化钠则可循环使用.根据以上叙述简要回答问题:
(1)用上述方法进行实验时,所用的起始原料 .(写出它们的化学式,下同).
(2)最终产品是 .
(3)有关的化学方程式 ; ; .
(4)有人认为侯氏制碱法的优点有以下四点:
A.生产过程中部分产品可作为起始原料使用;
B.副产品是一种可利用的氮肥;
C.反应不需要加热;
D.副产品不会造成环境污染.
你认为其中正确的是(用代号回答) .
查看习题详情和答案>>
(1)用上述方法进行实验时,所用的起始原料
(2)最终产品是
(3)有关的化学方程式
(4)有人认为侯氏制碱法的优点有以下四点:
A.生产过程中部分产品可作为起始原料使用;
B.副产品是一种可利用的氮肥;
C.反应不需要加热;
D.副产品不会造成环境污染.
你认为其中正确的是(用代号回答)
我国化工专家侯德榜发明了“联合制碱法”,其生产过程中发生的反应主要是:①NH3+CO2+H2O═NH4HCO3
②NH4HCO3+NaCl
NaHCO3↓+NH4Cl
③2NaHCO3
2Na2CO3+H2O+CO2↑.
在上述反应中没有涉及到的基本反应类型是( )
②NH4HCO3+NaCl
| ||
③2NaHCO3
| ||
在上述反应中没有涉及到的基本反应类型是( )
| A、置换反应 | B、化合反应 |
| C、分解反应 | D、复分解反应 |
23、化学就在我们身边.
(1)请你按要求选择合适物质的序号填空:
①活性炭 ②碳酸氢钠 ③食盐 ④纯碱 ⑤熟石灰
⑥烧碱 ⑦酒精 ⑧葡萄糖 ⑨干冰 ⑩氮气
发酵粉可以使食品松软可口,属于发酵粉成份之一,生活中人们称之为小苏打的是
(2)糖类、油脂、蛋白质和维生素都是人类的基本营养物质.下表为某品牌燕麦片标签中的一部分.
1麦片的营养成分中能与水反应生成氨基酸的营养物质是
②维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失.因此,烹调富含维生素C的食物时,应该注意
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
则羊毛的编号分别为
查看习题详情和答案>>
(1)请你按要求选择合适物质的序号填空:
①活性炭 ②碳酸氢钠 ③食盐 ④纯碱 ⑤熟石灰
⑥烧碱 ⑦酒精 ⑧葡萄糖 ⑨干冰 ⑩氮气
发酵粉可以使食品松软可口,属于发酵粉成份之一,生活中人们称之为小苏打的是
②
;常用来改良酸性土壤的碱是⑤
;我国著名化工专家侯德榜研究成功的“侯氏制碱法”所生产的“碱”是④
;生产上可以用作食品保护气的是⑩
;属于人体重要的供能物质是⑧
;可用于人工降雨的物质是⑨
.(2)糖类、油脂、蛋白质和维生素都是人类的基本营养物质.下表为某品牌燕麦片标签中的一部分.
| 每100g含有营养成分 | 糖类 | 油脂 | 蛋白质 | 维生素C | 钙 | 镁 | 钠 | 锌 |
| 7.6g | 7.8g | 7.4g | 18mg | 201mg | 18.2mg | 30.8mg | 8.1mg |
蛋白质
;人体必需的微量元素是锌
.②维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失.因此,烹调富含维生素C的食物时,应该注意
避免长时间高温加热
;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点食醋
.(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
③
.