题目内容
我国化工专家侯德榜曾为世界制碱工业作出了突出贡献.“侯氏制碱法”是以食盐、氨气、二氧化碳等为原料先制得N.HCq,进而生产出纯碱.其生产过程用化学方程式可简要表示为:①NH3+H2O+CO2=NH4HCO3;②NH4HCO3+NaCl=NaHCO3↓+NH4Cl;③2NaHCO3
| ||
(1)“侯氏制碱法”生产过程中涉及到的基本反应类型是
A.置换反应;B.化合反应;C.分解反应;D.复分解反应
(2)第②步中加入的是磨细的食盐粉,食盐磨细的目的是
若第②步中得到的NaHCO3中含有少量的NH4HCO3,但不会影响产品Na2CO3的纯度,原因是
(3)若纯碱中含有NaHCO3杂质,为测定试样中纯碱的质量分数,用右图中的装置进行实验.主要实验步骤如下:
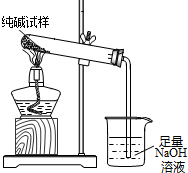
用天平准确称量出干燥试管的质量为20.2克,然后称取4.0克已研碎的纯碱样品并放入干燥的试管中.用酒精灯加热,待充分反应并冷却后,在天平上称出试管和碳酸钠的质量23.5克.
①停止加热前,要进行的操作是
②该试样中纯碱的质量分数为
分析:(1)只有熟悉四种基本反应类型的概念和特点,才能作出正确的判断.
(2)反应速率与反应物的接触面积有直接关系.
碳酸氢铵在加热条件下能分解且不留残余物.
(3)停止加热后试管内的气压会迅速降低.
减少的质量是生成水和二氧化碳的质量;由生成水和二氧化碳的质量可以计算出发生反应的碳酸氢钠的质量,进而计算出试样中纯碱的质量分数.
(2)反应速率与反应物的接触面积有直接关系.
碳酸氢铵在加热条件下能分解且不留残余物.
(3)停止加热后试管内的气压会迅速降低.
减少的质量是生成水和二氧化碳的质量;由生成水和二氧化碳的质量可以计算出发生反应的碳酸氢钠的质量,进而计算出试样中纯碱的质量分数.
解答:解:(1)①NH3+H2O+CO2=NH4HCO3该反应由三种物质反应生成一种物质,符合化合反应的概念,属于化合反应.
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl该反应由两种化合物互相交换成分形成两种新的化合物,符合复分解反应的概念,属于复分解反应.
③2NaHCO3
Na2CO3+H2O+CO2↑该反应由一种物质反应生成三种物质,符合分解反应的概念,属于分解反应.
因此“侯氏制碱法”生产过程中涉及到的基本反应类型是BCD.
(2)将食盐磨成食盐粉,可以增大反应物的接触面积,加快反应速率.
由于NH4HCO3
NH3↑+H2O+CO2↑,因此第②步中得到的NaHCO3中含有少量的NH4HCO3时不会影响产品Na2CO3的纯度.
(3)①为防止烧杯中的氢氧化钠溶液沿导气管倒流,停止加热后应先将导气管从氢氧化钠溶液中取出.
②设试样中纯碱的质量分数为x.
2NaHCO3
Na2CO3+H2O+CO2↑ 减少的质量
168 18 44 18+44=62
4.0g×(1-x) 20.2g+4.0g-23.5g=0.7g
=
,
x≈52.6%
故答案为:
(1)BCD;
(2)增大反应物的接触面积,加快反应速率;NH4HCO3
NH3↑+H2O+CO2↑.
(3)①先将导气管从氢氧化钠溶液中取出;
②52.6%
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl该反应由两种化合物互相交换成分形成两种新的化合物,符合复分解反应的概念,属于复分解反应.
③2NaHCO3
| ||
因此“侯氏制碱法”生产过程中涉及到的基本反应类型是BCD.
(2)将食盐磨成食盐粉,可以增大反应物的接触面积,加快反应速率.
由于NH4HCO3
| ||
(3)①为防止烧杯中的氢氧化钠溶液沿导气管倒流,停止加热后应先将导气管从氢氧化钠溶液中取出.
②设试样中纯碱的质量分数为x.
2NaHCO3
| ||
168 18 44 18+44=62
4.0g×(1-x) 20.2g+4.0g-23.5g=0.7g
| 168 |
| 62 |
| 4.0g×(1-x) |
| 0.7g |
x≈52.6%
故答案为:
(1)BCD;
(2)增大反应物的接触面积,加快反应速率;NH4HCO3
| ||
(3)①先将导气管从氢氧化钠溶液中取出;
②52.6%
点评:本题主要考查基本反应类型的判断和有关化学方程式的计算,难度较大.

练习册系列答案
相关题目
 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.