题目内容
(2012?扬中市模拟)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O═NH4HCO3;
NH4HCO3+NaCl═NaHCO3↓+NH4Cl;
2NaHCO3
Na2CO3+CO2↑+H2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
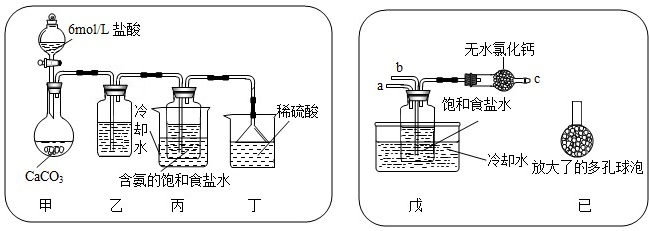
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 饱和的碳酸氢钠溶液,作用是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
(4)“纯碱中常常会混有少量氯化钠.”某研究性学习小组以一包纯碱(只考虑含氯化钠)为研究对象,探究纯碱样品中碳酸钠的含量.
【实验设计】
甲方案
Ⅰ.设计思路:根据样品与氯化钙溶液反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
Ⅱ.操作步骤:称取13.25g纯碱样品,加入过量的氯化钙溶液,充分搅拌.过滤、洗涤、干燥,得到的白色沉淀10.00g.
Ⅲ.数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数.
计算过程:
乙方案
I.设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
II.实验结论:
(1)当a、b的质量关系满足
=
(或22a=53b;或a=
b等)
=
(或22a=53b;或a=
b等)(填写含a、b字母的表达式,下同)时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%.
(2)当a、b的质量关系满足
>
>
时,纯碱样品室有碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是
×100%
×100%.
【实验评价】
误差分析:
(一)甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小.如果将氯化钙溶液换成氯化钡溶液,则可以使误差减小,理由是
(二)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比
NH3+CO2+H2O═NH4HCO3;
NH4HCO3+NaCl═NaHCO3↓+NH4Cl;
2NaHCO3
| ||
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
c
c
(填字母标号).a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 饱和的碳酸氢钠溶液,作用是
吸收甲装置可能挥发出的氯化氢气体
吸收甲装置可能挥发出的氯化氢气体
;(Ⅱ)丁装置中稀硫酸的作用是
吸收末反应的NH3
吸收末反应的NH3
;(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是
过滤
过滤
(填分离操作的名称).②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从
a
a
管通入氨气
氨气
气体;(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
增大气体与溶液接触面积,提高CO2吸收率
增大气体与溶液接触面积,提高CO2吸收率
;(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
用碳酸氢铵与适量饱和食盐水反应.(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等.其他合理方法均可)
用碳酸氢铵与适量饱和食盐水反应.(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等.其他合理方法均可)
.(4)“纯碱中常常会混有少量氯化钠.”某研究性学习小组以一包纯碱(只考虑含氯化钠)为研究对象,探究纯碱样品中碳酸钠的含量.
【实验设计】
甲方案
Ⅰ.设计思路:根据样品与氯化钙溶液反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
Ⅱ.操作步骤:称取13.25g纯碱样品,加入过量的氯化钙溶液,充分搅拌.过滤、洗涤、干燥,得到的白色沉淀10.00g.
Ⅲ.数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数.
计算过程:
解:设纯碱样品中含Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
=
x=10.6g
纯碱样品中Na2CO3的质量分数为
×100%=80%
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
| 106 |
| 100 |
| x |
| 10.00g |
x=10.6g
纯碱样品中Na2CO3的质量分数为
| 10.6g |
| 13.25g |
解:设纯碱样品中含Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
=
x=10.6g
纯碱样品中Na2CO3的质量分数为
×100%=80%
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
| 106 |
| 100 |
| x |
| 10.00g |
x=10.6g
纯碱样品中Na2CO3的质量分数为
| 10.6g |
| 13.25g |
乙方案
I.设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
II.实验结论:
(1)当a、b的质量关系满足
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
(2)当a、b的质量关系满足
| a |
| b |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| 53b |
| 22a |
| 53b |
| 22a |
【实验评价】
误差分析:
(一)甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小.如果将氯化钙溶液换成氯化钡溶液,则可以使误差减小,理由是
BaCl2比CaCl2的相对分子质量大,产生的沉淀质量大,称量误差小
BaCl2比CaCl2的相对分子质量大,产生的沉淀质量大,称量误差小
.(二)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比
偏小
偏小
(填“偏大”、“偏小”、或“不变”).分析:(1)依据碳酸氢钠溶解度相对较小分析判断;
(2)①(I)依据制取二氧化碳时常会含有氯化氢气体分析即可;
(II)依据稀硫酸能与氨气反应分析解答;
(III)依据分离固体与液体采用的实验操作分析解答;
②(I)从制取碳酸氢钠时先要得到含氨的饱和食盐水,以及氨气易溶于水分析判断;
(II)从装置改动后反应物的接触面积变大分析判断;
(3)从题干信息以及所学的制取碳酸氢钠的知识解决即可;
(4)【实验设计】甲方案:从生成的沉淀的质量利用化学方程式对碳酸钠的质量进行计算,进而求的碳酸钠的质量分数;
乙方案:Ⅰ设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
因此通过反应方程式对物质反应时的质量关系进行讨论即可;
(2)①(I)依据制取二氧化碳时常会含有氯化氢气体分析即可;
(II)依据稀硫酸能与氨气反应分析解答;
(III)依据分离固体与液体采用的实验操作分析解答;
②(I)从制取碳酸氢钠时先要得到含氨的饱和食盐水,以及氨气易溶于水分析判断;
(II)从装置改动后反应物的接触面积变大分析判断;
(3)从题干信息以及所学的制取碳酸氢钠的知识解决即可;
(4)【实验设计】甲方案:从生成的沉淀的质量利用化学方程式对碳酸钠的质量进行计算,进而求的碳酸钠的质量分数;
乙方案:Ⅰ设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
因此通过反应方程式对物质反应时的质量关系进行讨论即可;
解答:解:(1)由于对于氯化铵来说碳酸氢钠的溶解度更小一些,所以应首先析出,而碳酸氢钠的受热分解与该现象无关,碳酸氢钠易溶于水;
(2))①(I)利用盐酸制取二氧化碳时二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应,所以通过碳酸氢钠的溶液是为了除掉气体中的氯化氢气体;
(II)实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3;
(III)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作;
②(I)制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,而氨气极易溶于水,所以a端通入,从而保证了从b通入二氧化碳时保证了二氧化碳的充分反应;
(II)装置改动后反应物的二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率;
(3)从题干信息NH4HCO3+NaCl═NaHCO3↓+NH4Cl;可得制取碳酸氢钠的方法,同时也可采用烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠;
(4)【实验设计】甲方案
解:设纯碱样品中含Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
=
x=10.6g
纯碱样品中Na2CO3的质量分数为
×100%=80%
乙方案:Ⅰ设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
则有如下反应的质量关系:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
ag bg
=
即
=
实验结论:
(1)样品中碳酸钠的质量分数是100%.则两者的质量关系正好符合两物质的质量比,所以当a、b的质量关系满足
=
(或22a=53b;或a=
b等)(填写含a、b字母的表达式,下同)时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%.
(2)含有氯化钠时则反应的碳酸钠质量应该比ag要小,所以当a、b的质量关系满足
>
时,纯碱样品是由碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是
×100%.
【实验评价】
误差分析:(1)甲方案中,采用氯化钡进行反应时生成的碳酸钡的质量要比生成碳酸钙的质量大,因此测量时会使误差变小;
(2)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算碳酸钠结果与实际值相比偏小,所以导致碳酸钠的质量分数会偏小.
故答案为::(1)c;
(2))①(I)吸收甲装置可能挥发出的氯化氢气体;(II)吸收末反应的NH3;(III)过滤;
②(I)a;氨气;
(II)增大气体与溶液接触面积,提高CO2吸收率;
(3)用碳酸氢铵与适量饱和食盐水反应.(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等.其他合理方法均可);
(4)【实验设计】甲方案
解:设纯碱样品中含Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
=
x=10.6g
纯碱样品中Na2CO3的质量分数为
×100%=80%
乙方案:Ⅰ实验结论:
(1)
=
(或22a=53b;或a=
b等).
(2)
>
;
×100%.
【实验评价】
误差分析:(1)甲方案:BaCl2比CaCl2的相对分子质量大,产生的沉淀质量大,称量误差小;(2)乙方案中:偏小.
(2))①(I)利用盐酸制取二氧化碳时二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应,所以通过碳酸氢钠的溶液是为了除掉气体中的氯化氢气体;
(II)实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3;
(III)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作;
②(I)制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,而氨气极易溶于水,所以a端通入,从而保证了从b通入二氧化碳时保证了二氧化碳的充分反应;
(II)装置改动后反应物的二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率;
(3)从题干信息NH4HCO3+NaCl═NaHCO3↓+NH4Cl;可得制取碳酸氢钠的方法,同时也可采用烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠;
(4)【实验设计】甲方案
解:设纯碱样品中含Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
| 106 |
| 100 |
| x |
| 10.00g |
x=10.6g
纯碱样品中Na2CO3的质量分数为
| 10.6g |
| 13.25g |
乙方案:Ⅰ设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
则有如下反应的质量关系:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
ag bg
| 106 |
| 44 |
| ag |
| bg |
即
| 53 |
| 22 |
| a |
| b |
实验结论:
(1)样品中碳酸钠的质量分数是100%.则两者的质量关系正好符合两物质的质量比,所以当a、b的质量关系满足
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
(2)含有氯化钠时则反应的碳酸钠质量应该比ag要小,所以当a、b的质量关系满足
| a |
| b |
| 53 |
| 22 |
| 53b |
| 22a |
【实验评价】
误差分析:(1)甲方案中,采用氯化钡进行反应时生成的碳酸钡的质量要比生成碳酸钙的质量大,因此测量时会使误差变小;
(2)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算碳酸钠结果与实际值相比偏小,所以导致碳酸钠的质量分数会偏小.
故答案为::(1)c;
(2))①(I)吸收甲装置可能挥发出的氯化氢气体;(II)吸收末反应的NH3;(III)过滤;
②(I)a;氨气;
(II)增大气体与溶液接触面积,提高CO2吸收率;
(3)用碳酸氢铵与适量饱和食盐水反应.(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等.其他合理方法均可);
(4)【实验设计】甲方案
解:设纯碱样品中含Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.00g
| 106 |
| 100 |
| x |
| 10.00g |
x=10.6g
纯碱样品中Na2CO3的质量分数为
| 10.6g |
| 13.25g |
乙方案:Ⅰ实验结论:
(1)
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
(2)
| a |
| b |
| 53 |
| 22 |
| 53b |
| 22a |
【实验评价】
误差分析:(1)甲方案:BaCl2比CaCl2的相对分子质量大,产生的沉淀质量大,称量误差小;(2)乙方案中:偏小.
点评:此题是一道实验探究综合题,充分的展示了化学知识的方方面面,该题综合性强难度较大,对训练学生良好地思维品质以及知识的严密性有较好的帮助.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目

