摘要:2.镁和加NaOH溶液分别 与等浓度.等体积的过量稀硫酸反应.产生气体的体积关系如图.反应中镁和加NaOH溶液的( ) A.物质的量之比为3∶2 B.质量之比为3∶2 C.摩尔质量之比为2∶3 D.反应速率之比为2∶3 解析 镁与稀硫酸反应:Mg+H2SO4===MgSO4+H2↑.加NaOH溶液与稀硫酸反应:2Al+3H2SO4===Al2(SO4)3+3H2↑.由图象知.产生的H2的量相同.各产生1 mol H2时.需Mg 1 mol.质量为24 g,需Almol.质量为18 g.故A正确.B.C错误.Mg的反应速率大于Al的.D错误. 答案 A
网址:http://m.1010jiajiao.com/timu3_id_69570[举报]
下列实验能达到预期目的的是
A.加NaOH溶液后进行分液分离乙醇和苯酚
B.MgCl2、AlCl3溶液中分别通入NH3,比较镁、铝的金属性强弱
C.测定Na2CO3、Na2SO4两溶液的pH,比较碳、硫的非金属性强弱
D.称量2.9gNa2CO3?10H2O晶体溶于100 mL 水配制取0.10 mol?L-1 的纯碱溶液
查看习题详情和答案>>
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象发如表:
请你帮助该同学整理并完成实验报告
(1)实验目的:
(2)实验用品:仪器、材料
(3)实验内容:(填写题给信息表中的序号或大写英文字母,并写出有空格处的离子方程式)
(4)实验结论:
查看习题详情和答案>>
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 |
A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
(1)实验目的:
同周期元素金属性,非金属性性质逆变规律.
同周期元素金属性,非金属性性质逆变规律.
(2)实验用品:仪器、材料
试管、酒精灯、砂纸、胶头滴管
试管、酒精灯、砂纸、胶头滴管
药品金属钠、镁条、铝条、酚酞试液、盐酸、氯化铝溶液、氢氧化钠溶液、冷水和沸水、新制的H2S饱和溶液、氯水
金属钠、镁条、铝条、酚酞试液、盐酸、氯化铝溶液、氢氧化钠溶液、冷水和沸水、新制的H2S饱和溶液、氯水
(3)实验内容:(填写题给信息表中的序号或大写英文字母,并写出有空格处的离子方程式)
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不 填 | |
| 不 填 | ||
| 不 填 | ||
| E | ||
| F |
同周期元素随原子序数的增大,元素的金属性逐渐减弱,而非金属逐渐增强
同周期元素随原子序数的增大,元素的金属性逐渐减弱,而非金属逐渐增强
. 某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:①分别配制50mL物质的量浓度均为0.100mol?L-1CuSO4溶液和NaOH溶液;
②准确量取10mLCuSO4溶液倒入50mL烧杯中;
③向烧杯中匀速加入0.100mol?L-1NaOH溶液,并每加入1.00mLNaOH溶液用pH计测一次混合溶液的pH;
④当滴入NaOH溶液的体积达到30mL时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时pH变化曲线.
请回答以下问题:
(1)V(NaOH)在0.00mL~2.00mL之间时,溶液中无沉淀产生,但pH变化较快的原因是
OH-未与Cu2+结合,而是与Cu2+水解产生的H+反应
OH-未与Cu2+结合,而是与Cu2+水解产生的H+反应
;(2)V(NaOH)在2.00mL~15.00mL之间时,溶液中产生绿色沉淀,并不断增加,经检测此沉淀为碱式硫酸铜.已知蒸馏水的pH为6.32,当V(NaOH)为15.00mL时,溶液pH为6.30,则可求得x=
1
1
,y=
2
2
;(3)V(NaOH)在17.00mL~20.00mL之间时,溶液中出现蓝色沉淀,并不断增加.已知V(NaOH)为20.00mL时,溶液pH为12.25,则此时沉淀中
含
含
(填“含”或“不含”)有碱式硫酸铜,理由是加入CuSO4的与NaOH的物质的量之比为1:2,且溶液pH为12.25,说明NaOH为完全反应,应存在碱式碳酸铜
加入CuSO4的与NaOH的物质的量之比为1:2,且溶液pH为12.25,说明NaOH为完全反应,应存在碱式碳酸铜
.图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分;
②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%.
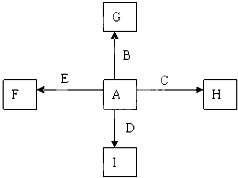
回答下列问题.
(1)反应①的化学方程式是 .
(2)化合物I中所存在的化学键是 键(填“离子”或“极性”或“非极性”).
(3)称取11.9g B、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用足量的稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液中加入过量的NaOH溶液,所得沉淀的质量为 .
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是: .
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 (从下面的选项中选择正确选项,下同),欲检验其中的Fe2+的方案是 .
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红褐色.
查看习题详情和答案>>
①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分;
②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%.

回答下列问题.
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是
(3)称取11.9g B、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用足量的稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液中加入过量的NaOH溶液,所得沉淀的质量为
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红褐色.