摘要:20.A.B.C.D.E.F为原子序数依次增大的主族元素.已知A.C.F三原子的最外层共有11个电子.且这三种元素的最高价氧化物的水化物之间两两皆能反应.均能生成盐和水.D元素原子的最外层电子数比次外层电子数少4.E元素原子次外层电子数比最外层电子数多3.回答:(1)写出下列元素的符号:A .D .E , (2)用电子式写出B.F形成的化合物的电子式 ,(3)A.C两种元素最高价氧化物的水化物反应的离子方程式为 ,(4)D的固态氧化物是 晶体.含n molD的氧化物的晶体中含D-O共价键为 mol.
网址:http://m.1010jiajiao.com/timu3_id_68113[举报]
A、B、C、D、E、F为原子序数依次增大的六种元素,其中除F外均为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E、F的单质均为固体,且F单质是目前世界上使用量最大的金属.A是所有元素中原子半径最小的元素,C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个.请用化学用语回答下列问题:
(1)C的离子结构示意图为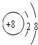
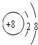 ;D与E两元素的离子半径:D
;D与E两元素的离子半径:D
(2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为
(3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为
(4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH
(5)已知一定条件下,D单质与氧化物F3O4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式
(6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl2溶液,也有白色沉淀产生.则该复盐的化学式为
查看习题详情和答案>>
(1)C的离子结构示意图为
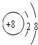
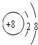
<
<
E(填“>”、“<”或“=”).(2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为
CH3-CH3
CH3-CH3
.(3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.(4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH
<
<
7(填“>”、“<”或“=”).化合物AB3是一种无色的液态物质,受撞击会分解成两种单质,请写出该反应的化学方程式2HN3=H2↑+3N2↑
2HN3=H2↑+3N2↑
.(5)已知一定条件下,D单质与氧化物F3O4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式
8Al+3Fe3O4
4Al2O3+9Fe
| ||
8Al+3Fe3O4
4Al2O3+9Fe
.
| ||
(6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl2溶液,也有白色沉淀产生.则该复盐的化学式为
NH4Al(SO4)2
NH4Al(SO4)2
.A、B、C、D、E、F为原子序数依次增大的短周期主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层少4个;E元素原子次外层电子数比最外层多3个.
(1)写出下列元素的符号:A ,E .
(2)A、C两种元素的最高价氧化物的水化物反应的离子方程式是 .
(3)A元素的最高价氧化物的水化物与C元素的最高价氧化物反应的化学方程式是 .
(4)与F元素处于同一主族的第四周期元素的基态原子核外电子排布式为 .
查看习题详情和答案>>
(1)写出下列元素的符号:A
(2)A、C两种元素的最高价氧化物的水化物反应的离子方程式是
(3)A元素的最高价氧化物的水化物与C元素的最高价氧化物反应的化学方程式是
(4)与F元素处于同一主族的第四周期元素的基态原子核外电子排布式为
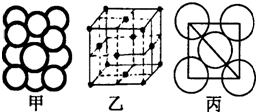 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.已知:
A原子的核外电子数与电子层数相等;
B元素原子的核外P电子数比S电子数少l个;
C原子的第一至第四电离能为:I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol;
D原子核外所有P轨道为全充满或半充满;
E元素的族序数与周期序数的差为4;
(1)写出E元索在周期表位置:
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为:
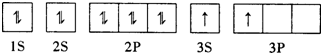
该同学所画的轨道式违背了
(3)已知BA5为离子化合物,写出其电子式:
(4)DE3中心原子杂化方式为
(5)某金属晶体中原子堆积方式如图甲,晶胞特征如图乙,原子相对位置关系如图丙;则晶胞中该原子配位数为
(已知该金属相对原子质量为m,原子半径为a cm)
A、B、C、D、E、F为原子序数依次增大的同一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E.G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
(1)写出E元素在元素周期表中的位置为 .
(2)D的原子结构示意图为 .
(3)用电子式表示出B、F形成化合物的过程: .
(4)以上元素中原子半径最大的是 金属性最强的元素是 (均用元素名称回答).
(5)实验室制备G的氢化物的化学方程式: .
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是 .
②相应的化学方程式: .
查看习题详情和答案>>
(1)写出E元素在元素周期表中的位置为
(2)D的原子结构示意图为
(3)用电子式表示出B、F形成化合物的过程:
(4)以上元素中原子半径最大的是
(5)实验室制备G的氢化物的化学方程式:
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是
②相应的化学方程式:
 A、B、C、D、E、F为原子序数依次增大的六种短周期元素.A、D处于同一主族,D、E、F处于同一周期,F原子的最外层电子数是A、B、D原子最外层电子数之和.C2-与D+核外电子层结构相同.A、B组成的常见气体X能使湿润的红色石蕊试纸变蓝;F的单质与X反应能生成B的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;E的单质既能与D元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐N;D、F可组成化合物M.
A、B、C、D、E、F为原子序数依次增大的六种短周期元素.A、D处于同一主族,D、E、F处于同一周期,F原子的最外层电子数是A、B、D原子最外层电子数之和.C2-与D+核外电子层结构相同.A、B组成的常见气体X能使湿润的红色石蕊试纸变蓝;F的单质与X反应能生成B的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;E的单质既能与D元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐N;D、F可组成化合物M. 请回答下列问题
(1)写出用电子式表示M的形成过程:
(2)含C元素的18电子分子有很多,其中含非极性键的化合物的结构式为:
(3)Y的水溶液显酸性原因是
(4)将Y溶液与L溶液混合生成大量白色沉淀,该反应的离子方程式为:
(5)按图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式: