题目内容
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分元素的相关信息,利用下表回答相关问题
(1)请画出16号元素原子结构示意图 化学反应中该原子比较容易 (填“得到”或“失去”)电子变成离子;
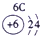
(2) 表示的是 (填离子符号);
表示的是 (填离子符号);
(3)上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是 (填化学式,任意填写一种);
(4)上表中第二、三周期元素最外层电子数的变化规律是 .
| 第一周期 | 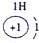 |
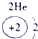 | ||||||
| 第二周期 | 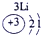 |
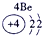 |
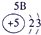 |
 |
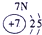 |
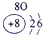 |
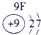 |
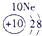 |
| 第三周期 | 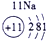 |
 |
 |
 |
 |
 | ||
(2)
 表示的是
表示的是(3)上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是
(4)上表中第二、三周期元素最外层电子数的变化规律是
分析:(1)原子核内质子数=核电荷数=原子序数;
(2)根据离子的核电荷数与核外电子数的关系来回答;
(3)周期表中最活泼金属元素在右下角位置,地壳中含量最多的元素是Al;
(4)根据元素周期律中每一周期元素原子的最外层电子数的地变规律来回答.
(2)根据离子的核电荷数与核外电子数的关系来回答;
(3)周期表中最活泼金属元素在右下角位置,地壳中含量最多的元素是Al;
(4)根据元素周期律中每一周期元素原子的最外层电子数的地变规律来回答.
解答:解:根据原子结构知识,可以确定16号元素原子是硫原子,核外16个电子,最外层6个电子,S元素的非金属性较强,在反应中易得到电子,原子结构示意图为: ,故答案为:
,故答案为: ;得到;
;得到;
(2)阳离子的核电荷数=核外电子数+失电子数,原子核内质子数=核电荷数,所以13号元素是Al,核外电子数是10,所以表示的是Al3+,故答案为:Al3+;
(3)周期表中从左到右金属的活泼性逐渐减弱,从上到下,金属的活泼性逐渐增强,所以最活泼金属元素在右下角位置,应为Na,地壳中含量最多的元素是O,二者可以形成氧化钠或是过氧化钠,故答案为:Na2O(或Na2O2);
(4)第二、三周期元素最外层电子数随着原子序数的递增逐渐从1增加到7,故答案为:最外层电子数随着原子序数的递增逐渐从1增加到7.
 ,故答案为:
,故答案为: ;得到;
;得到;(2)阳离子的核电荷数=核外电子数+失电子数,原子核内质子数=核电荷数,所以13号元素是Al,核外电子数是10,所以表示的是Al3+,故答案为:Al3+;
(3)周期表中从左到右金属的活泼性逐渐减弱,从上到下,金属的活泼性逐渐增强,所以最活泼金属元素在右下角位置,应为Na,地壳中含量最多的元素是O,二者可以形成氧化钠或是过氧化钠,故答案为:Na2O(或Na2O2);
(4)第二、三周期元素最外层电子数随着原子序数的递增逐渐从1增加到7,故答案为:最外层电子数随着原子序数的递增逐渐从1增加到7.
点评:本题考查学生元素周期表和元素周期律的综合知识,难度不大.

练习册系列答案
相关题目
镓(Ga)是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属IIIA族,熔点为29.78℃,沸点高达2403℃。由此判断下列有关镓的性质及其用途的叙述错误的是

| A.镓原子的最外层电子数为3 |
| B.常温常压下镓能熔化在我们的手心里 |
| C.镓是制造高温温度计的上佳材料 |
| D.Al(OH)3和Ga(OH)3均是两性氢氧化物 |