题目内容
X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其申Y、W位 于同一主族,Z、W位于同一周期;Y的最外层电子数是K层电子数的3倍;Z是同一周期中金属性最强的元素,X为非金属元素,其最外层电子数与Z相同.请回答下列问题:
(1)Y的元素名称是 .
(2)Z2W的电子式是 .
(3)Z Y X中含有的化学键为 .
(4)Z2Y2与X2Y反应的离子方程式是: .
(5)A和B均由以上四种元素构成,请写出它们之间反应的离子方程式: .
(6)若把铜片放入X2WY4溶液中,溶液无明显的变化,若在X2WY4溶液中加入X2Y2后,观察到铜片附近的溶液变蓝色,请写出反应的化学方程式: .
(1)Y的元素名称是
(2)Z2W的电子式是
(3)Z Y X中含有的化学键为
(4)Z2Y2与X2Y反应的离子方程式是:
(5)A和B均由以上四种元素构成,请写出它们之间反应的离子方程式:
(6)若把铜片放入X2WY4溶液中,溶液无明显的变化,若在X2WY4溶液中加入X2Y2后,观察到铜片附近的溶液变蓝色,请写出反应的化学方程式:
分析:X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其申Y、W位于同一主族,则Y处于第二周期、W处于第三周期,Y的最外层电子数是K层电子数的3倍,则Y最外层电子数为6,故Y为氧元素,则W为硫元素;Z、W位于同一周期,Z是同一周期中金属性最强的元素,则Z为钠元素;X为非金属元素,其最外层电子数与Z相同,则X为氢元素.
解答:解:X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其申Y、W位于同一主族,则Y处于第二周期、W处于第三周期,Y的最外层电子数是K层电子数的3倍,则Y最外层电子数为6,故Y为氧元素,则W为硫元素;Z、W位于同一周期,Z是同一周期中金属性最强的元素,则Z为钠元素;X为非金属元素,其最外层电子数与Z相同,则X为氢元素.
故X为氢元素、Y为氧元素、Z为钠元素、W为硫元素.
(1)由上述分析可知,Y为氧元素,故答案为:氧;
(2)Z为钠元素、W为硫元素,二者形成Na2S,Na2S是离子化合物由钠离子与硫离子构成,电子式为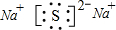 ,故答案为:
,故答案为: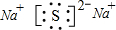 ;
;
(3)X为氢元素、Y为氧元素、Z为钠元素,ZYX为NaOH,是离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成极性键,故答案为:离子键、极性键;
(4)X为氢元素、Y为氧元素、Z为钠元素,过氧化钠与水反应生成氢氧化钠与氧气,反应离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(5)A和B均由以上四种元素构成,A、B为硫酸氢钠与亚硫酸氢钠,反应离子方程式为HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(6)过氧化钠与硫酸反应生成硫酸钠与氧气、水,反应方程式为2Na2O2+2H2SO4=Na2SO4+2H2O+O2↑,在氧气存在条件下,氧气、铜与硫酸反应生硫酸铜与水,反应方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案为:2Na2O2+2H2SO4=Na2SO4+2H2O+O2↑、2Cu+O2+2H2SO4=2CuSO4+2H2O.
故X为氢元素、Y为氧元素、Z为钠元素、W为硫元素.
(1)由上述分析可知,Y为氧元素,故答案为:氧;
(2)Z为钠元素、W为硫元素,二者形成Na2S,Na2S是离子化合物由钠离子与硫离子构成,电子式为
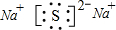 ,故答案为:
,故答案为: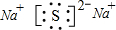 ;
;(3)X为氢元素、Y为氧元素、Z为钠元素,ZYX为NaOH,是离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成极性键,故答案为:离子键、极性键;
(4)X为氢元素、Y为氧元素、Z为钠元素,过氧化钠与水反应生成氢氧化钠与氧气,反应离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(5)A和B均由以上四种元素构成,A、B为硫酸氢钠与亚硫酸氢钠,反应离子方程式为HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(6)过氧化钠与硫酸反应生成硫酸钠与氧气、水,反应方程式为2Na2O2+2H2SO4=Na2SO4+2H2O+O2↑,在氧气存在条件下,氧气、铜与硫酸反应生硫酸铜与水,反应方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案为:2Na2O2+2H2SO4=Na2SO4+2H2O+O2↑、2Cu+O2+2H2SO4=2CuSO4+2H2O.
点评:本题考查结构与物质关系、常用化学用语等,是对基础知识的综合考查,难度中等,根据元素位置关系,推断元素所处的周期是解题的关键.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
X、Y、Z、Q、W为按原予序数由小到大排列的五种短周期元素。已知:①X与Q处于同一主族,其原子价电子排布式都为ns2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)XY2分子的空间构型为 。
(2)QX的晶体结构与金刚石的相似,微粒间存在的作用力是 。
(3)晶体ZW的熔点比晶体XW4明显高的原因是 。
(4)XY2在高温高压下所形成的晶胞如图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)漏体,该晶体中X原子的杂化形式为___ 。

(5)氧化物MO的电子总数与QX的相等,则M为 。(填元素符号);MO是优良的耐高温材料,其晶体结构与ZW晶体结构相似,MO的熔点比CaO的高,其原因是 。





