题目内容
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C是同一周期相邻的三种元素,B、D、F元素原子最外电子层的p能级(轨道)上的电子均处于半满状态,元素E的最高正价氧化物的水化物在同周期元素的最高正价氧化物的水化物中酸性最强.
请回答下列问题:
(1)A、B、C三元素的第一电离能由大到小的顺序为 (用对应的元素符号填空,下空同),三者的电负性由大到小的顺序为
(2)A、B、C三元素的氢化物分子的空间结构分别是
(3)B、D、F三元素的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是 .
(4)F元素原子基态时的核外电子排布式为 .
(5)由B、E两种元素组成的化合物X,常温下为易挥发的淡黄色液体,x分子为三角锥形分子,且分子里B、E两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质,则X分子的电子式为 ,X分子的中心原子的杂化轨道类型为 ,X与水反应的化学方程式是 .
(6)另有一种位于周期表中ds区的元素G,该元素单质形成的晶体晶胞如图所示,若假设该原子半径为r,相对原子质量为Mr,则该元素单质的密度可表示为 .(用NA表示阿伏加德罗常数)
请回答下列问题:
(1)A、B、C三元素的第一电离能由大到小的顺序为
(2)A、B、C三元素的氢化物分子的空间结构分别是
(3)B、D、F三元素的氢化物的沸点从高到低排列次序是(填化学式)
(4)F元素原子基态时的核外电子排布式为
(5)由B、E两种元素组成的化合物X,常温下为易挥发的淡黄色液体,x分子为三角锥形分子,且分子里B、E两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质,则X分子的电子式为

(6)另有一种位于周期表中ds区的元素G,该元素单质形成的晶体晶胞如图所示,若假设该原子半径为r,相对原子质量为Mr,则该元素单质的密度可表示为
分析:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F,其中B、D、F原子最外电子层的p能级(轨道)上的电子处于半满状态,外围电子排布为ns2np3,处于ⅤA族,则B为N元素,D为P元素,F为As元素;A、B、C是同一周期相邻的三种元素,则A为碳元素、C为O元素;元素E的最高正价氧化物的水化物在同周期元素的最高正价氧化物的水化物中酸性最强,其原子序数小于As,大于P元素,则E处于第三周期,故E为Cl元素,据此解答.
解答:解:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F,其中B、D、F原子最外电子层的p能级(轨道)上的电子处于半满状态,外围电子排布为ns2np3,处于ⅤA族,则B为N元素,D为P元素,F为As元素;A、B、C是同一周期相邻的三种元素,则A为碳元素、C为O元素;元素E的最高正价氧化物的水化物在同周期元素的最高正价氧化物的水化物中酸性最强,其原子序数小于As,大于P元素,则E处于第三周期,故E为Cl元素,
(1)同周期自左而右第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;同周期自左而右电负性增大,故电负性O>N>C,
故答案为:N>O>C;O>N>C;
(2)C、N、O三元素的氢化物分子分别为CH4、NH3、H2O,空间结构分别是:正四面体、三角锥形、V形,
故答案为:正四面体、三角锥形、V形;
(3)N、P、As三元素的氢化物分别为NH3、PH3、AsH3,都形成分子晶体,但NH3分子之间存在氢键,AsH3、PH3分子之间为范德华力,氢键比范德华力更强,NH3沸点最高,相对分子质量越大,范德华力越强,故沸点AsH3>PH3,沸点从高到低排列次序是NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3;NH3分子之间存在氢键,AsH3、PH3分子之间为范德华力,氢键比范德华力更强,NH3沸点最高,相对分子质量越大,范德华力越强,AsH3沸点比PH3高;
(4)F为As元素,处于第四周期ⅤA族,原子基态时的核外电子排布式为1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(5)由N、Cl两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里N、Cl两种原子最外层均达到8个电子的稳定结构,则X为NCl3,则NCl3分子的电子式为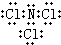 ,NCl3分子的中心N原子价层电子对数为4,N原子采取sp3杂化,NCl3遇水蒸气可形成一种常见的漂白性物质,生成HClO,同时生成NH3,反应方程式为:NCl3+3H2O═NH3+3HClO,
,NCl3分子的中心N原子价层电子对数为4,N原子采取sp3杂化,NCl3遇水蒸气可形成一种常见的漂白性物质,生成HClO,同时生成NH3,反应方程式为:NCl3+3H2O═NH3+3HClO,
故答案为: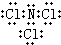 ;sp3;NCl3+3H2O═NH3+3HClO;
;sp3;NCl3+3H2O═NH3+3HClO;
(6)另有一种位于周期表中ds区的元素G,由该元素单质形成的晶体晶胞可知,晶胞中G原子数目=8×
+6×
=4,则晶胞质量=
g,原子半径为r,则晶胞棱长=4r×
=2
r,晶胞体积=(2
r)3=16
r3,则该元素单质的密度为
=
,
故答案为:
.
(1)同周期自左而右第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;同周期自左而右电负性增大,故电负性O>N>C,
故答案为:N>O>C;O>N>C;
(2)C、N、O三元素的氢化物分子分别为CH4、NH3、H2O,空间结构分别是:正四面体、三角锥形、V形,
故答案为:正四面体、三角锥形、V形;
(3)N、P、As三元素的氢化物分别为NH3、PH3、AsH3,都形成分子晶体,但NH3分子之间存在氢键,AsH3、PH3分子之间为范德华力,氢键比范德华力更强,NH3沸点最高,相对分子质量越大,范德华力越强,故沸点AsH3>PH3,沸点从高到低排列次序是NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3;NH3分子之间存在氢键,AsH3、PH3分子之间为范德华力,氢键比范德华力更强,NH3沸点最高,相对分子质量越大,范德华力越强,AsH3沸点比PH3高;
(4)F为As元素,处于第四周期ⅤA族,原子基态时的核外电子排布式为1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(5)由N、Cl两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里N、Cl两种原子最外层均达到8个电子的稳定结构,则X为NCl3,则NCl3分子的电子式为
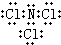 ,NCl3分子的中心N原子价层电子对数为4,N原子采取sp3杂化,NCl3遇水蒸气可形成一种常见的漂白性物质,生成HClO,同时生成NH3,反应方程式为:NCl3+3H2O═NH3+3HClO,
,NCl3分子的中心N原子价层电子对数为4,N原子采取sp3杂化,NCl3遇水蒸气可形成一种常见的漂白性物质,生成HClO,同时生成NH3,反应方程式为:NCl3+3H2O═NH3+3HClO,故答案为:
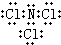 ;sp3;NCl3+3H2O═NH3+3HClO;
;sp3;NCl3+3H2O═NH3+3HClO;(6)另有一种位于周期表中ds区的元素G,由该元素单质形成的晶体晶胞可知,晶胞中G原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4Mr |
| NA |
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| ||
16
|
| Mr | ||
4
|
故答案为:
| Mr | ||
4
|
点评:本题考查物质结构与性质,题目比较综合,涉及结构性质位置关系、电负性、电离能、核外电子排布、分子结构与性质、杂化理论、晶胞计算等,侧重考查主干知识,需要学生具备扎实的基础知识,难度中等,(6)为易错点、难点,计算晶胞棱长是关键.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: