摘要:(09南师附中高考化学模拟12分)已知A.B.C.D.E都是元素周期表中前四周期的元素.它们的核电荷数A<B<C<D<E.B原子的p轨道半充满.形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26.E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况.回答下列问题:(答题时.A.B.C.D.E用所对应的元素符号表示) (1)A.B.C.D的第一电离能由小到大的顺序为 . (2)C的氢化物分子是 分子. (3)化合物BD3的分子空间构型是 . (4)E元素原子的核外电子排布式是 ,E的一种常见配合物E(CO)5常温下呈液态.熔点为-20.5℃.沸点为103℃.易溶于非极性溶剂.据此可判断E(CO)5的晶体类型为 (5)金属E单质的晶体在不同温度下有两种堆积方式.晶胞分别如右图所示.体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为 .
网址:http://m.1010jiajiao.com/timu3_id_66091[举报]
 已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:
已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:(1)写出下列元素的符号:A
B
B
、BAl
Al
、CP
P
;(2)上述五种元素中最高价氧化物对应水化物酸性最强的是
HClO4
HClO4
,(填写化学式)碱性最强的是

(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
Cl
Cl
,电负性最大的元素是Cl
Cl
;(4)在AD3分子中A元素原子的原子轨道发生的是
sp2
sp2
杂化,分子空间构型为平面三角形
平面三角形
;(5)将B 的单质投入E的最高价氧化物对应水化物中,发生反应生成物中有此离子[B(OH)4]-离子方程式是
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
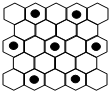
.(6)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为
KC8
KC8
. (2012?梧州模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(2012?梧州模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)(1)E的核外电子排布式是
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
,A、B、C、D的第一电离能由小到大的顺序为Al<Mg<S<N
Al<Mg<S<N
.(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是
氯化镁是离子晶体,氯化铝是分子晶体
氯化镁是离子晶体,氯化铝是分子晶体
;(3)A的最高价含氧酸根离子中,其中心原子采取
sp2
sp2
杂化,D的低价氧化物分子的空间构型是V形
V形
.(4)A、E形成某种化合物的晶胞结构如下图所示,则其化学式为
Cu3N
Cu3N
;(每个球均表示1个原子)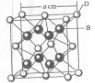 (2011?开封一模)[化学--选修物质结构与性质]
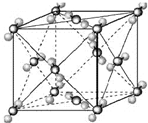
(2011?开封一模)[化学--选修物质结构与性质]已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如图.请回答:
(1)A与c形成的共价化合物的分子式是
SiH4
SiH4
,杂化轨道是sp3
sp3
,分子的立体结构是正四面体
正四面体
.(2)B与C比较,电负性较小的是
Si
Si
(填元素符号);B与c形成的化合物晶体类型是分子晶体
分子晶体
. (3)E属元素周期表中第
四
四
周期,第ⅡB
ⅡB
族的元素,其元素名称是锌
锌
,它的+2价离子的电子排布式为1s22s22p63s2sp63d10
1s22s22p63s2sp63d10
.(4)从图中可以看出,D踉B形成的离子化合物的化学式为
CaF2
CaF2
;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.试回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.(2)A、B、C的第一电离能由大到小的顺序为
N>C>Si
N>C>Si
.(3)B元素的单质分子中有
2
2
个π键,与其互为等电子体的物质的化学式可能为CO(或其他合理答案)
CO(或其他合理答案)
(任写一种).(4)上述A的氧化物分子的中心原子采取
sp
sp
杂化,其晶胞中微粒间的作用力为范德华力
范德华力
.(5)EH3分子的空间构型为
三角锥形
三角锥形
,其沸点与BH3相比低
低
(填“高”或“低”),原因是NH3分子间能形成氢键,AsH3分子间不能形成氢键
NH3分子间能形成氢键,AsH3分子间不能形成氢键
.(6)向CuSO4溶液中逐滴加入BH3的水溶液,得到深蓝色的透明溶液.请写出该反应的离子方程式
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
. (2011?郑州二模)[化学--选修物质结构与性质]
(2011?郑州二模)[化学--选修物质结构与性质]已知A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次增大.B、C、D同周期,A、D同主族,B,C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.E元素的原子核外共有20种不同运动状态的电子,且E的原子序数比D大4.
(1)B、C的第一电离能较大的是
Al
Al
(填元素符号).(2)A的氢化物的分子空间构型为
V型或折线型
V型或折线型
,其中心原子采取sp3
sp3
杂化.(3)A和D的氢化物中,沸点较高的是
H2O
H2O
(填化学式),其原因是水分子之间可以形成氢键,而H2S分子之间不能形成氢键
水分子之间可以形成氢键,而H2S分子之间不能形成氢键
.(4)仅由A与B元素组成,且含有非极性键的化合物是
Na2O2
Na2O2
(填化学式).(5)E的核外电子排布式是
1S22S22P63S23P64S2
1S22S22P63S23P64S2
.(6)B的最高价氧化物对应的水化物,其溶液与C单质反应的化学方程式是
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑或2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑或2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(7)E单质在A单质中燃烧时得到一种白色晶体,其晶体的晶胞结构如右图所示,则该晶体的化学式为
CaO2
CaO2
.