题目内容
 (2011?郑州二模)[化学--选修物质结构与性质]
(2011?郑州二模)[化学--选修物质结构与性质]已知A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次增大.B、C、D同周期,A、D同主族,B,C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.E元素的原子核外共有20种不同运动状态的电子,且E的原子序数比D大4.
(1)B、C的第一电离能较大的是
Al
Al
(填元素符号).(2)A的氢化物的分子空间构型为
V型或折线型
V型或折线型
,其中心原子采取sp3
sp3
杂化.(3)A和D的氢化物中,沸点较高的是
H2O
H2O
(填化学式),其原因是水分子之间可以形成氢键,而H2S分子之间不能形成氢键
水分子之间可以形成氢键,而H2S分子之间不能形成氢键
.(4)仅由A与B元素组成,且含有非极性键的化合物是
Na2O2
Na2O2
(填化学式).(5)E的核外电子排布式是
1S22S22P63S23P64S2
1S22S22P63S23P64S2
.(6)B的最高价氧化物对应的水化物,其溶液与C单质反应的化学方程式是
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑或2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑或2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(7)E单质在A单质中燃烧时得到一种白色晶体,其晶体的晶胞结构如右图所示,则该晶体的化学式为
CaO2
CaO2
.分析:A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次增大.B、C、D同周期,B,C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,
则B为Na,C为Al;E元素的原子核外共有20种不同运动状态的电子,则E为Ca,且E的原子序数比D大4,则D为S,A、D同主族,则A为O,然后利用元素及其单质、化合物的性质、结构等来解答.
则B为Na,C为Al;E元素的原子核外共有20种不同运动状态的电子,则E为Ca,且E的原子序数比D大4,则D为S,A、D同主族,则A为O,然后利用元素及其单质、化合物的性质、结构等来解答.
解答:解:A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次增大.B、C、D同周期,B,C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,
则B为Na,C为Al;E元素的原子核外共有20种不同运动状态的电子,则E为Ca,且E的原子序数比D大4,则D为S,A、D同主族,则A为O,
即A为O,B为Na,C为Al,D为S,E为Ca,
(1)B为Na,C为Al,Al的最外层电子半满,为稳定结构,则Al的第一电离能较大,故答案为:Al;
(2)A的氢化物为H2O,分子构型为V型或折线型,O有2对孤对电子和两个共价单键,则杂化类型为sp3,
故答案为:V型或折线型;sp3;
(3)H2O与H2S相比较,水分子之间可以形成氢键,而H2S分子之间不能形成氢键,则水的沸点高,
故答案为:H2O;水分子之间可以形成氢键,而H2S分子之间不能形成氢键;
(4)仅由A与B元素组成的化合物有Na2O、Na2O2,且含有非极性键的化合物为Na2O2,故答案为:Na2O2;
(5)E为Ca,电子排布式为1S22S22P63S23P64S2,故答案为:1S22S22P63S23P64S2;
(6)B的最高价氧化物对应的水化物为NaOH,与Al反应的化学方程式为2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
或2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑或2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(7)由晶体的晶胞结构图可知,O22-占据棱点和体心,个数为12×
+1=4,钙离子占据顶点和面心,个数为8×
+6×
=4,个数比为1:1,
则化学式为CaO2,故答案为:CaO2.
则B为Na,C为Al;E元素的原子核外共有20种不同运动状态的电子,则E为Ca,且E的原子序数比D大4,则D为S,A、D同主族,则A为O,
即A为O,B为Na,C为Al,D为S,E为Ca,
(1)B为Na,C为Al,Al的最外层电子半满,为稳定结构,则Al的第一电离能较大,故答案为:Al;
(2)A的氢化物为H2O,分子构型为V型或折线型,O有2对孤对电子和两个共价单键,则杂化类型为sp3,
故答案为:V型或折线型;sp3;
(3)H2O与H2S相比较,水分子之间可以形成氢键,而H2S分子之间不能形成氢键,则水的沸点高,
故答案为:H2O;水分子之间可以形成氢键,而H2S分子之间不能形成氢键;
(4)仅由A与B元素组成的化合物有Na2O、Na2O2,且含有非极性键的化合物为Na2O2,故答案为:Na2O2;
(5)E为Ca,电子排布式为1S22S22P63S23P64S2,故答案为:1S22S22P63S23P64S2;
(6)B的最高价氧化物对应的水化物为NaOH,与Al反应的化学方程式为2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
或2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑或2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(7)由晶体的晶胞结构图可知,O22-占据棱点和体心,个数为12×
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
则化学式为CaO2,故答案为:CaO2.
点评:本题考查位置、结构、性质的关系,元素的推断是解答本题的关键,并熟悉物质结构和性质的关系来解答即可,难度较大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
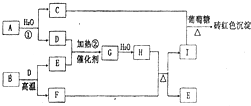 (2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
(2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,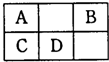 (2011?郑州二模)如图是元素周期表中短周期元素的一部分,A、D两元素原子核内质子数之和为23.下列有关说法中,不正确的是( )
(2011?郑州二模)如图是元素周期表中短周期元素的一部分,A、D两元素原子核内质子数之和为23.下列有关说法中,不正确的是( ) (2011?郑州二模)如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
(2011?郑州二模)如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )