题目内容
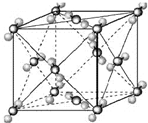 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.试回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.(2)A、B、C的第一电离能由大到小的顺序为
N>C>Si
N>C>Si
.(3)B元素的单质分子中有
2
2
个π键,与其互为等电子体的物质的化学式可能为CO(或其他合理答案)
CO(或其他合理答案)
(任写一种).(4)上述A的氧化物分子的中心原子采取
sp
sp
杂化,其晶胞中微粒间的作用力为范德华力
范德华力
.(5)EH3分子的空间构型为
三角锥形
三角锥形
,其沸点与BH3相比低
低
(填“高”或“低”),原因是NH3分子间能形成氢键,AsH3分子间不能形成氢键
NH3分子间能形成氢键,AsH3分子间不能形成氢键
.(6)向CuSO4溶液中逐滴加入BH3的水溶液,得到深蓝色的透明溶液.请写出该反应的离子方程式
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
.分析:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态,则B应为N,其电子排布式应为1S22S22P3,D为P,其电子排布式应为1S22S22P63S23P3;A的一种氧化物分子为非极性分子,由晶胞结构可知为二氧化碳分子,则A为C;以C单质为代表的第一代半导体材料,则C为Si;GaE为代表的第二代半导体材料,则E为As,然后结合物质结构及化学用语来解答.
解答:解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态,则B应为N,其电子排布式应为1S22S22P3,D为P,其电子排布式应为1S22S22P63S23P3;A的一种氧化物分子为非极性分子,由晶胞结构可知为二氧化碳分子,则A为C;以C单质为代表的第一代半导体材料,则C为Si;GaE为代表的第二代半导体材料,则E为As,
(1)Ga的原子序数为31,则基态Ga原子的核外电子排布式为1s22s22p63s23p63d104s24p1,故答案为:1s22s22p63s23p63d104s24p1;
(2)非金属性越强,第一电离能越大,则第一电离能为N>C>Si,故答案为:N>C>Si;
(3)氮气的结构为N≡N,含2个π键,具有相同原子数和价电子数的微粒为等电子体,则与其互为等电子体的物质的化学式可能为CO,
故答案为:2;CO(或其他合理答案);
(4)A的氧化物分子为CO2,为直线结构,则中心C原子采取sp杂化,其晶胞中微粒间的作用力为范德华力,故答案为:sp;范德华力;
(5)E为As,AsH3分子的空间构型与氨气分子相似,均为三角锥形,因NH3分子间能形成氢键,AsH3分子间不能形成氢键,则其沸点与BH3相比低,
故答案为:三角锥形;低;NH3分子间能形成氢键,AsH3分子间不能形成氢键;
(6)向CuSO4溶液中逐滴加入NH3的水溶液,得到深蓝色的透明溶液,生成四氨合铜络离子,离子反应为Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,故答案为:Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(1)Ga的原子序数为31,则基态Ga原子的核外电子排布式为1s22s22p63s23p63d104s24p1,故答案为:1s22s22p63s23p63d104s24p1;
(2)非金属性越强,第一电离能越大,则第一电离能为N>C>Si,故答案为:N>C>Si;
(3)氮气的结构为N≡N,含2个π键,具有相同原子数和价电子数的微粒为等电子体,则与其互为等电子体的物质的化学式可能为CO,
故答案为:2;CO(或其他合理答案);
(4)A的氧化物分子为CO2,为直线结构,则中心C原子采取sp杂化,其晶胞中微粒间的作用力为范德华力,故答案为:sp;范德华力;
(5)E为As,AsH3分子的空间构型与氨气分子相似,均为三角锥形,因NH3分子间能形成氢键,AsH3分子间不能形成氢键,则其沸点与BH3相比低,
故答案为:三角锥形;低;NH3分子间能形成氢键,AsH3分子间不能形成氢键;
(6)向CuSO4溶液中逐滴加入NH3的水溶液,得到深蓝色的透明溶液,生成四氨合铜络离子,离子反应为Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,故答案为:Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
点评:本题考查位置、结构、性质的关系,侧重原子结构知识的考查,推断出元素的种类是解答本题的关键,E的推断是解答的难点,注意常见的半导体材料,推断时注意从原子的核外电子排布特点以及元素的特殊性质为突破口解答,题目难度较大.

练习册系列答案
相关题目