摘要:26.10℃时.在烧杯中加入0.1mol/L的 NaHCO3溶液400mL.加热.测得该溶液的pH发生如下变化: 温度(℃) 10 20 30 50 70 pH 8.3 8.4 8.5 8.9 9.4 (1)甲同学认为.该溶液的pH升高的原因是HCO3-的水解程度增大.故碱性增强.该反应的离子方程式为 . (2)乙同学认为.溶液pH升高的原因是NaHCO3受热分解.生成了Na2CO3.并推断Na2CO3的水解程度 NaHCO3 . (3)丙同学认为.要确定上述哪种说法合理.只要把加热后的溶液冷却到10℃后再测定溶液的pH.若pH8.3 .说明甲正确.若pH 8.3.说明乙正确. (4)丁同学设计如下实验方案对甲.乙同学的解释进行判断: 实验装置如右图.加热煮沸NaHCO3溶液.发现试管A中产生沉淀.说明 推测正确. (5)资料:将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸.测其pH为9.8,将烧杯冷却至室温.过一段时间测得pH为10.1.据此资料可以判断 推测正确.原因是 .
网址:http://m.1010jiajiao.com/timu3_id_64549[举报]
10℃时,在烧杯中加入0.1mol/L的NaHCO3溶液400mL,加热,测得该溶液的PH发生如下变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为: ;
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH 8.3(填“>”、“<”或“=”),说明乙正确;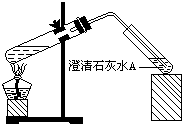
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明 (填“甲”或“乙”)推断正确;
(5)将一定体积0.1mol/L的NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为10.4;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为9.5.据此资料可以判断 (填“甲”或“乙”)推测正确,原因是 .
查看习题详情和答案>>
| 温度(℃) | 10 | 20 | 30 | 40 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH

(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明
(5)将一定体积0.1mol/L的NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为10.4;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为9.5.据此资料可以判断
10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为______;
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
______(填“大于”或“小于”)NaHCO3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH______8.3(填“>”、“<”或“=”),说明甲正确,若pH______8.3(填“>”、“<”或“=”),说明乙正确;
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明______(填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断______(填“甲”或“乙”)推测正确,原因是______.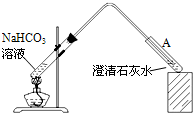
查看习题详情和答案>>
| 温度(℃) | 10 | 20 | 30 | 50 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
______(填“大于”或“小于”)NaHCO3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH______8.3(填“>”、“<”或“=”),说明甲正确,若pH______8.3(填“>”、“<”或“=”),说明乙正确;
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明______(填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断______(填“甲”或“乙”)推测正确,原因是______.

10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为______;
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
______(填“大于”或“小于”)NaHCO3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH______8.3(填“>”、“<”或“=”),说明甲正确,若pH______8.3(填“>”、“<”或“=”),说明乙正确;
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明______(填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断______(填“甲”或“乙”)推测正确,原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
| 温度(℃) | 10 | 20 | 30 | 50 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
______(填“大于”或“小于”)NaHCO3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH______8.3(填“>”、“<”或“=”),说明甲正确,若pH______8.3(填“>”、“<”或“=”),说明乙正确;
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明______(填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断______(填“甲”或“乙”)推测正确,原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
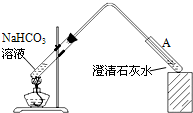 (2009?佛山一模)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
(2009?佛山一模)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:| 温度(℃) | 10 | 20 | 30 | 50 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
;(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
大于
大于
(填“大于”或“小于”)NaHCO3;(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH
=
=
8.3(填“>”、“<”或“=”),说明甲正确,若pH>
>
8.3(填“>”、“<”或“=”),说明乙正确;(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明
乙
乙
(填“甲”或“乙”)推测正确;(5)将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断
乙
乙
(填“甲”或“乙”)推测正确,原因是溶液冷却至室温后pH大于8.4,说明此实验过程中溶液有新物质生成
溶液冷却至室温后pH大于8.4,说明此实验过程中溶液有新物质生成
.运用化学知识解决生产、生活中的有关问题备受关注。请回答下列问题:
(1)已知水存在如下平衡:H2O![]() H++OH- △H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是 。
H++OH- △H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是 。
A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯。当400mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
 (4)实验室中采用惰性电极模拟工业上电解饱和食盐水的过程:
(4)实验室中采用惰性电极模拟工业上电解饱和食盐水的过程:
①写出C1电极上发生反应的电极反应式 。
②当C2电极上产生112mL(标准状况)气体时(假设气体完全
逸出,溶液体积不变),烧杯中溶液的pH= 。(Kw=10-14)
查看习题详情和答案>>