网址:http://m.1010jiajiao.com/timu3_id_64138[举报]
A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.原子处于基态时,A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一电离能至第四电离能(kJ/mol)分别为:
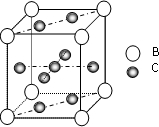
578,1817、2745、11575;E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:
(1)写出A的基态核外电子排布式
(2)C2+和A2+都能与NH3、H2O等形成配位数为4的配合物.[A(NH3)4]2+和[C(NH3)4]2+都具有对称的空间构型,[C(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,而[A(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种产物,则[C(NH3)4]2+的空间构型为
(3)1mol D的单质分子中存在
(4)实验测得气态无水Q在1.01ⅹ105Pa,t1℃的密度为5.00g/L,气体摩尔体积为53.4L/mol,则此时Q的组成为(写化学式)
[选修物质结构与性质](15分)
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式 ,F元素原子的电子排布式 ,E元素的原子结构示意图是 。
(2)化合物乙中含有的化学键是 。
(3)化合物甲为固体时属于 晶体,E单质在一定条件下与甲反应的化学方程式为 。
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的B原子
查看习题详情和答案>>
[选修物质结构与性质](15分)
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式 ,F元素原子的电子排布式 ,E元素的原子结构示意图是 。
(2)化合物乙中含有的化学键是 。
(3)化合物甲为固体时属于 晶体,E单质在一定条件下与甲反应的化学方程式为  。
。
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的B原子
[选修物质结构与性质](15分)
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式 ,F元素原子的电子排布式 ,E元素的原子结构示意图是 。
(2)化合物乙中含有的化学键是 。
(3)化合物甲为固体时属于 晶体,E单质在一定条件下与甲反应的化学方程式为 。
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的B原子

查看习题详情和答案>>
[化学——物质结构与性质]
A、B、C、D、E、F六种元素的原子序数依次递增。已知:①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布为msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)下列叙述正确的是 ;
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大与最小的两种元素形成的晶体化学式为EB,属于离子晶体
D.晶格能:NaCl<DCl2
(2)F的核外电子排布式是 ;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素是 (填元素符号);
(3)A与C形成的非极性分子中,σ键与π键数之比为 。
查看习题详情和答案>>