网址:http://m.1010jiajiao.com/timu3_id_63640[举报]
方案一:
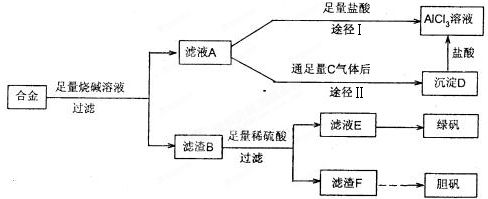
试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈、烧杯和漏斗,还要补充的玻璃仪器是
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是
(3)从滤液E中得到绿矾晶体的实验操作是
(4)写出用滤渣F制备胆矾晶体的化学方程式
方案二:
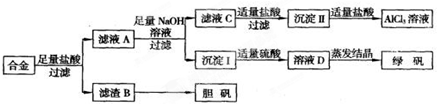
请回答下列问题:
(5)写出由滤液C到沉淀Ⅱ的离子方程式
(6)小组成员经过检测,发现制得的绿矾不纯,试分析原因
(7)方案一和方案二,你认为哪种方案相对
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下: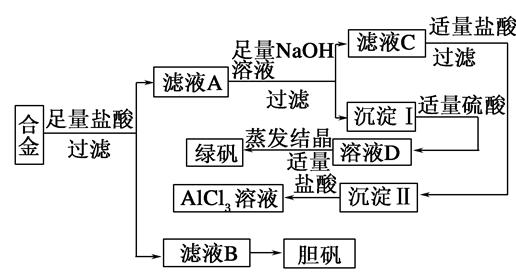
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理” 或“不合理”),理由是__________。
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
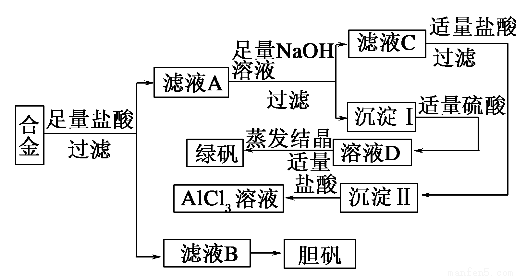
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理” 或“不合理”),理由是__________。
查看习题详情和答案>>
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(![]() )和胆矾晶体(
)和胆矾晶体(![]() ),其实验方案如下:
),其实验方案如下:

试回答下列问题:
(1)过滤用的玻璃仪器有_______________________。
(2)写出由沉淀Ⅱ转化为AlC13溶液的离子方程式_____________________。
(3)小组成员经过检测.发现制得的绿矾不纯,试分析原因___________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进_________________________
(4)小组成员从资料中获知H2O;是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O:来制备胆矾晶体,则该反应的总化学方程式为________________________________
(5)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前方案______(填“更合理”或“不合理”),理由是_____
查看习题详情和答案>>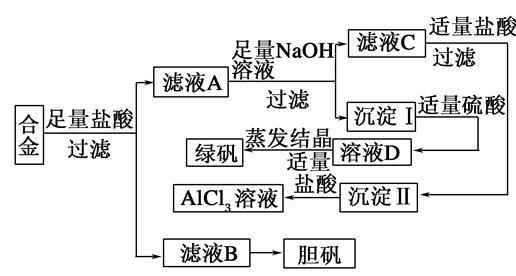
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理” 或“不合理”),理由是__________。