题目内容
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
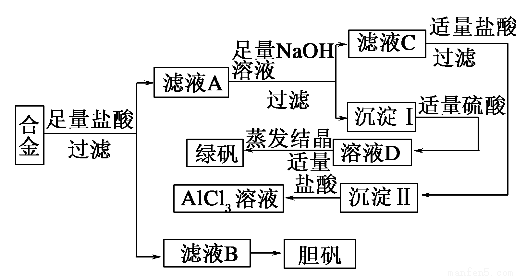
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理” 或“不合理”),理由是__________。
(1)烧杯、漏斗、玻璃棒
(2)反应过程中部分二价铁转化成了三价铁 向溶液D中加入足量铁粉,反应后过滤,取滤液蒸发结晶即可得绿矾
(3)Cu+H2O2+H2SO4=CuSO4+2H2O
(4)更合理 因为前一种方案操作步骤多、时间长、消耗试剂量过大
【解析】(1)过滤属于基本操作,玻璃仪器有烧杯、漏斗、玻璃棒。
(2)Fe2+很容易被空气中的氧气氧化为Fe3+,加入足量铁粉于溶液中,就可以使Fe3+转化为Fe2+,从而使滤液蒸发结晶即可得绿矾。
(3)稀H2SO4不能直接氧化Cu,加入氧化性的H2O2可氧化。
(4)实验评价在于比较,一般是从试剂成本、反应时间(生产效率)等方面思考,故后者更合理。

练习册系列答案
相关题目